上期我们已经对AAV在免疫细胞中的靶向策略从注射方式的角度进行了讨论。免疫细胞的种类繁多,因为免疫细胞本身的特性它的感染效率不高,针对免疫细胞的特异性的启动子种类也比较少。随着细胞和基因治疗的火热进行,有越来越多的针对靶向免疫细胞的AAV进行了研究,接下来小编将分成几期进行相关的实例分析。这一期我们一起来看看针对巨噬细胞做的相关研究。
Engineering monocyte/macrophage−specific glucocerebrosidase expression in human hematopoietic stem cells using genome editing[1]

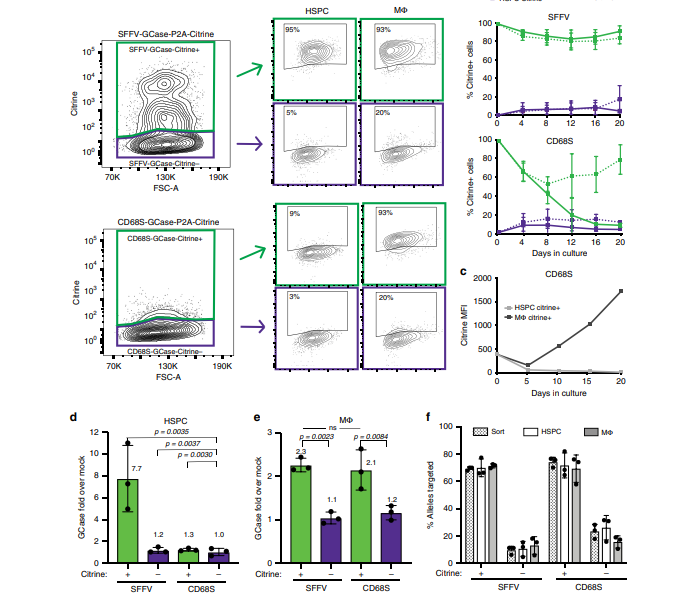
高雪氏病(GD)是由GBA基因突变引起的遗传学疾病,它导致葡萄糖脑苷酯酶(GCase)缺乏,从而导致高糖脂降解负担造成很多细胞累积糖脂,尤其是巨噬细胞。主要有三种临床类型:GD1、GD2和GD3。GD1是最常见的表型,通常表现为肝脾肿大、骨疾病以及细胞减少还有不同程度的肺部疾病。目前治疗GD1的方法包括口服葡糖苷酸合成酶的小分子抑制剂(SRT)和葡萄糖脑苷脂酶替代物(ERT)靶向巨噬细胞通过甘露糖介导的摄取。除此之外,异体造血干细胞移植已经成功用于GD的一次性治疗。它的治疗效果是通过提供移植的GCase组分的巨噬细胞。这表明仅恢复巨噬细胞的GC酶功能就可以纠正GD1的表型。因此,在病人自己的造血系统中恢复GC酶的活性建立一种自体的方法,就可以避免异体造血干细胞的许多风险。
由于这些原因,研究人员通过把非靶向的基因添加到人类造血干细胞和祖细胞中进行探索:首先使用的是逆转录病毒后来使用慢病毒载体,在小鼠的GD模型中取得了很好的结果。由于插入性突变和恶性转化的发生,需要开发针对性的基因添加策略,以产生人类治疗的转基因HSPCs。现代基因组编辑工具可以实现单碱基对精度的基因修饰和整合。细菌CRISPR/Cas9系统衍生出的一个高度可工程化的平台已被优化用于基因编辑。Cas9会刺激两种修复途径的一种:(1) 非同源末端连接(NHEJ)以及(2)同源定向修复(HDR)。
在人类HSPCs中,AAV6基因组是一种有效的同源修复方法。HDR途径不仅可以利用来实现单碱基对的变化,而且还可以将整个表达盒整合到非必要的安全港位点,从而实现调控区、转基因和可选择标记的可调整组合的稳定表达。一个潜在的安全港基因座是CCR5。这篇文献中,研究人员利用RNP(sgRNA和Cas9核糖核蛋白复合物)/AAV6平台,实现了GCase盒能有效的整合到CCR5安全位点。并且利用一个在单核细胞/巨噬细胞中高度表达的系谱特异性启动子的启动子,研究人员实现了GCase在受影响的细胞系中的表达,同时也尽量减少在造血干细胞和祖细胞中的异位表达。
如下图所示,研究人员为了验证CD68S启动子的系别特异性,将CD68S-GCase-Citrine+和SFFV-GCase-Citrine+与HSPCs一起培养。SFFV-GCase-Citrine+细胞的比例在HSPC和巨噬细胞中都保持稳定。相反,CD68S-GCase-Citrine+细胞的百分比在HSPC培养物中减少,但在巨噬细胞培养物中保持不变。由CD68SGCase-Citrine+和SFFV-GCase-Citrine+HSPCs衍生的巨噬细胞表达的GCase比巨噬细胞高2-3倍。
病毒产品 | AAV6-CD68S |
实验动物 | NSG小鼠 |
注射方式 | 体外感染细胞,回输小鼠 |
注射量 | MOI=1*104~2*104 |
STING Induces Liver Ischemia-Reperfusion Injury by Promoting Calcium-Dependent Caspase 1-GSDMD Processing in Macrophages[2]

主要内容:
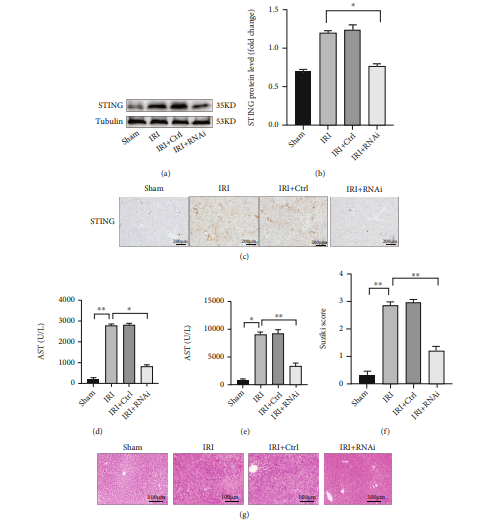
巨噬细胞中干扰素基因刺激因子(STING)对肝脏缺血再灌注损伤(IRI)有重要的调节作用,但是STING依赖性的先天免疫的基本机制激活肝脏巨噬细胞(Kupffer)的机制仍然不清楚。这篇文献研究了STING对肝脏巨噬细胞的热化作用以及肝脏IRI的相关调节机制。使用了磷酸脂质体来阻断肝脏的巨噬细胞,然后使用AAV-STING-RNAi-F4/80-EGFP转染到小鼠的门静脉中,在14天之后建立了肝脏的IRI模型。体外实验使用了STING特异性的siRNA处理肝脏的巨噬细胞,建立了缺氧-复氧(H/R)模型。结果表明,STING的表达随着肝脏IRI的增加而增加,但是在磷酸脂质体阻断肝脏巨噬细胞之后,STING的表达量明显下降。敲除STING后,巨噬细胞中的Caspase 1-GSDMD的激活和肝脏IRI得到了缓解。更有趣的是,缺氧/复氧(H/R)增加了肝脏巨噬细胞中的钙离子浓度,但STING敲除后,钙离子浓度却下降。BAPTA-AM抑制肝脏巨噬细胞的钙离子后,巨噬细胞的热化现象明显减少,但STING的表达却没有明显减少。这些结果表明敲除STING可以减少钙依赖性的巨噬细胞caspase 1-GSDMD介导的肝脏IRI,是一种潜在的治疗方法。
在本文中,研究人员证实敲除巨噬细胞中的STING可减轻肝脏IRI。在肝脏IRI建模前14天,用AAV-STING-RNAi-F4/80-EGFP预处理(静脉注射)小鼠,对照组病毒为AAV-Ctrl-F4/80-EGFP。从各组肝脏中分离出KCs,然后用WB以及免疫组化检测各组KCs中STING的表达。
病毒产品 | AAV6-F4/80 |
实验动物 | C57BL/6N野生型小鼠(8-10周) |
注射方式 | 门静脉(肝巨噬细胞Kupffer) |
注射量 | 1 × 1011vg |
Mannose receptor modulates macrophage polarization and allergic inflammation through miR-511-3p[3]

主要内容:
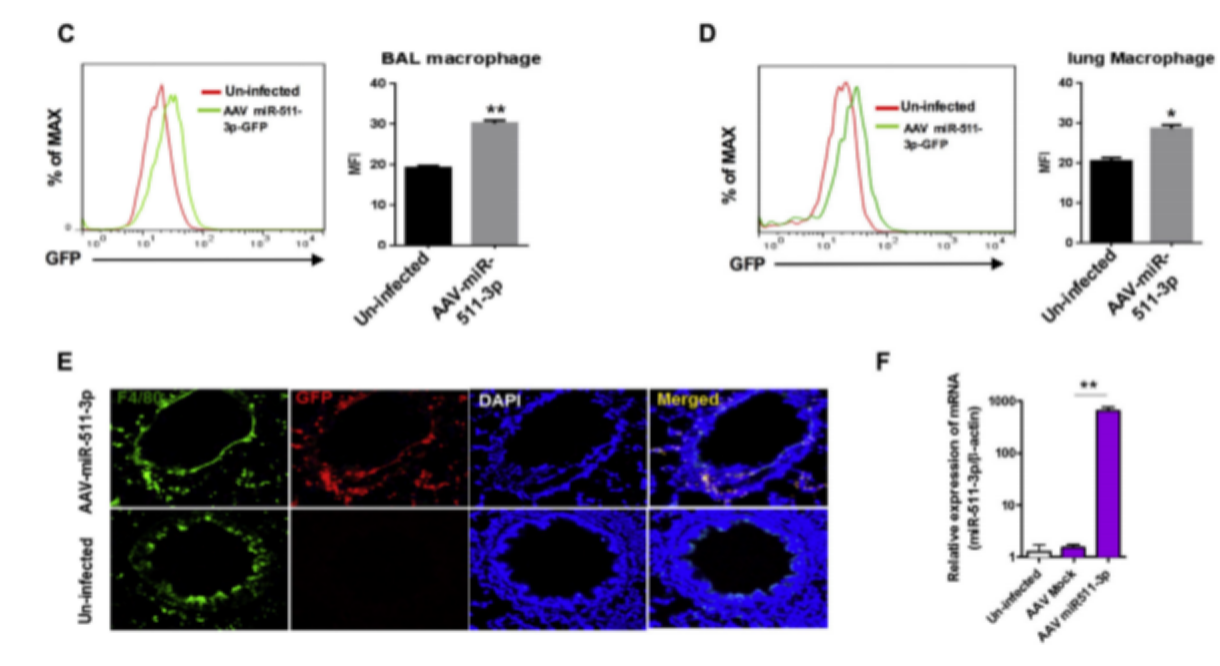
甘露糖受体(MRC1/CD206)被认为是通过多种糖类过敏原介导过敏性吸食和哮*。研究人员证明了一种保护机制,在该机制中MRC1通过其内含的miR-511-3p限制过敏性炎症。作者利用野生型C57和MRC1介导的肺巨噬细胞对过敏原的摄取和肺部炎症进行了研究。在巨噬细胞的极化和过敏原的诱导中miR-511-3p的作用是在转染了(AAV)–miR-511-3p的小鼠中诱导肺部的炎症。
如下图:研究人员通过一个表达miR-511-3p的AAV载体(AAV-CMV-EG)感染小鼠,通过流式去检测BAL和肺部巨噬细胞的表达,通过免疫荧光进行染色也进行了验证。之后用这些被AAV感染的小鼠用于小鼠哮*模型的建立。结果表明被AAV-miR-511-3p感染的小鼠大大抑制了由造模引起的支气管周围炎症和绒毛膜细胞增生。
病毒产品 | AAV9-CMV |
实验动物 | C57BL/6N野生型小鼠(6-8周) |
注射方式 | 气管内注射(肺巨噬) |
注射量 | 5x1010 pfu~1 × 1011vg |
拓展阅读

公众号底部菜单栏【新功能】上线!
病毒实验帮
免费在线学习《国自然热点研究》、《数据库及软件操作教程》
一键下载《病毒使用手册》、《高分文献》
还有不定时的送新书、抽奖活动,赶紧来扫码关注一波吧
参考文献…
向上滑动阅览
1.Scharenberg, S.G., et al., Engineering monocyte/macrophage-specific glucocerebrosidase expression in human hematopoietic stem cells using genome editing. Nat Commun, 2020. 11(1): p. 3327.
2.Wu, X.Y., et al., STING Induces Liver Ischemia-Reperfusion Injury by Promoting Calcium-Dependent Caspase 1-GSDMD Processing in Macrophages. Oxid Med Cell Longev, 2022. 2022: p. 8123157.
3.Zhou, Y., et al., Mannose receptor modulates macrophage polarization and allergic inflammation through miR-511-3p. J Allergy Clin Immunol, 2018. 141(1): p. 350-364 e8.
