回顾了一下以前被咨询到的问题,发现被各位老师问到最多的一个就是载体带什么荧光比较好,或者要不要带荧光,荧光是不是一定要带,该怎么带,又该如何去选择荧光。光是想想,就成了一个繁琐又让人头大的问题,今天我们就来捋一捋,看如何在色彩斑斓的荧光中挑到属于自己的那款。

图1:市场上常用荧光蛋白展示【1】
1. 什么荧光比较好?
回答这个问题,我们需要转换一下角度,与其是选择最hao的荧光,不如说是选择合适自己实验体系的荧光。举个例子,在细胞感染病毒或者转染质粒之后下一步要面对的就是细胞学实验,在林林总总的细胞学实验中,有这样一类实验叫做凋亡检测,而检测结果目前文章最首肯的是双荧光检测的结果,很不巧这里的FITC荧光信号,凋亡前期使用的是绿色荧光,后期使用的是红色荧光。如果我们的细胞中携带红色或者绿色荧光,那么对于我们凋亡检测而言是会有具大的干扰。那我就不能带荧光了嘛?也不是这样,如果可以避开红光,绿光或者其他波长相近的荧光蛋白,选择其他波长差异较大的,也是可以使用的。
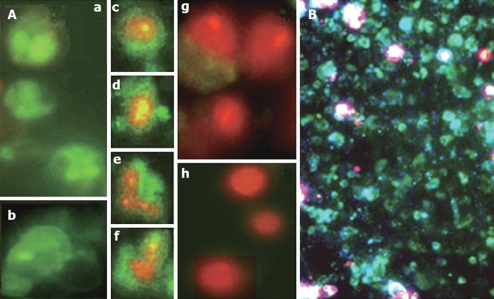
图2:细胞凋亡检测Annexin V-FITC/PI 染色结果【2】
2.荧光是融合还是非融合,这两者有什么差异?
对于这个问题,我们先讨论一下两者使用的场景,首先什么时候需要融合荧光?荧光的常规用途是什么呢,方便告知我们细胞中有没有被载体成功转染,毕竟只有成功转染载体的细胞才有荧光嘛,展开一下,同样的道理,如果蛋白上融合了荧光蛋白,那么是不是只有这个蛋白才会被荧光示踪,蛋白在哪它在哪,两者执子之手,与子共生,蛋白多荧光就亮,蛋白少荧光就暗淡。这里就是融合荧光蛋白的两个主要作用,观察蛋白定位以及对表达量做相对定量,如果做了调控,可以从荧光强度的相对变化判断其趋势。
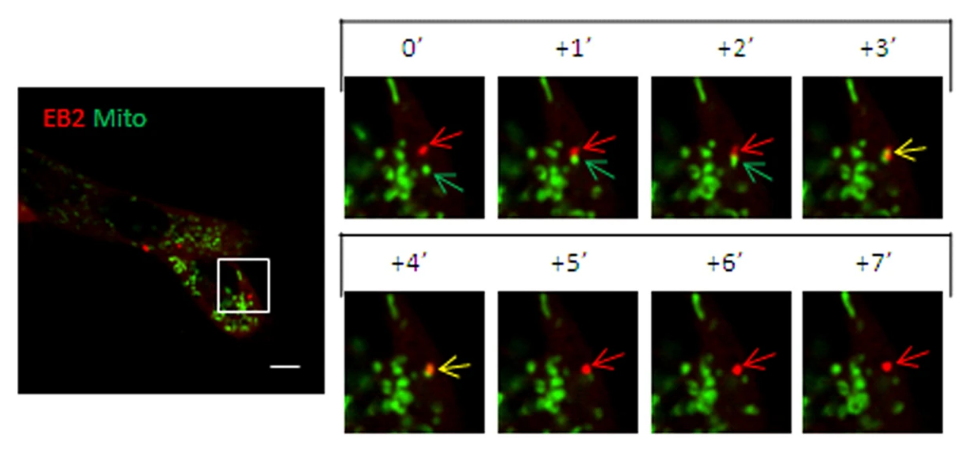
图3:线粒体定位信号偶联GFP标记线粒体(吉凯载体)【3】
那什么是非融合呢?就是各做各的,蛋白独立表达,荧光蛋白岁月静好,不会因为其中一者被影响连带另一个也被影响,自然这种情况下就没有办法像融合荧光一样看定位,看表达量变化趋势。
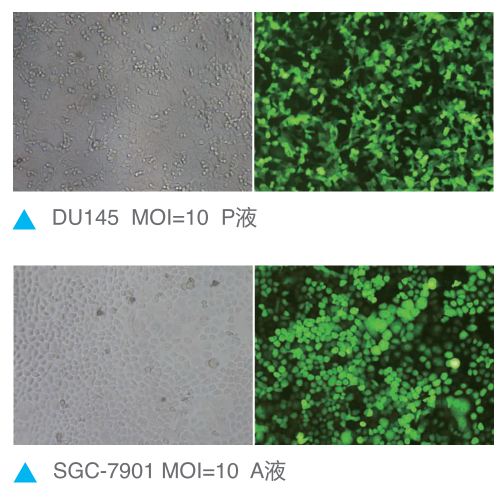
图4:携带荧光的慢病毒感染细胞观察荧光效果(吉凯载体)
3.那些场景下使用哪些荧光蛋白?
1.转染/感染后观察荧光:常规选择EGFP/mCherry这类荧光蛋白,但不绝对,需要结合后续的实验选择具体的荧光蛋白标签。提供一个各类荧光蛋白以及波长的链接供各位老师细细挑选(https://doi.org/10.1002/0471143030.cb2105s36)或者联系相关工作人员获取文献。

2.活体成像类实验:常规选择萤火虫荧光素酶Fluc(Firefly luciferase),通过和荧光素钠盐或者钾盐这类底物在ATP的供能下产生荧光,并不需要被激发,极大减少了背景底噪带来的影响,同时因为较大的波长,被肌体吸收的情况较荧光蛋白好很多,提高成像的效果。
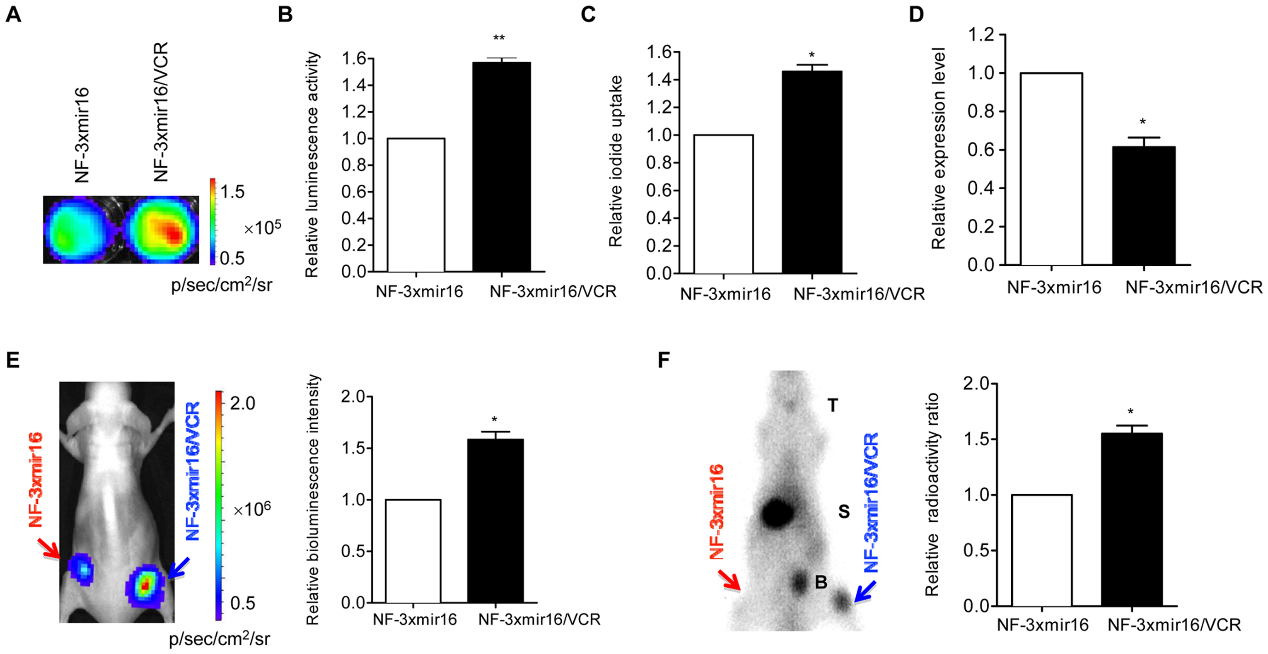
图5:FLUC细胞注射后活体成像分析调控带来的影响(吉凯慢病毒)【4】
备选通常是海肾荧光素酶Rluc(Renilla Luciferase),该酶可以氧化腔肠素产生能量并在此过程中产生荧光,和萤火虫荧光素酶不同的是,该体系不需要ATP的参与,但是因为低于Fluc的波长,且相对靠近肌体的吸收波长,同时特异性要差一些,成像效果上不如Fluc。
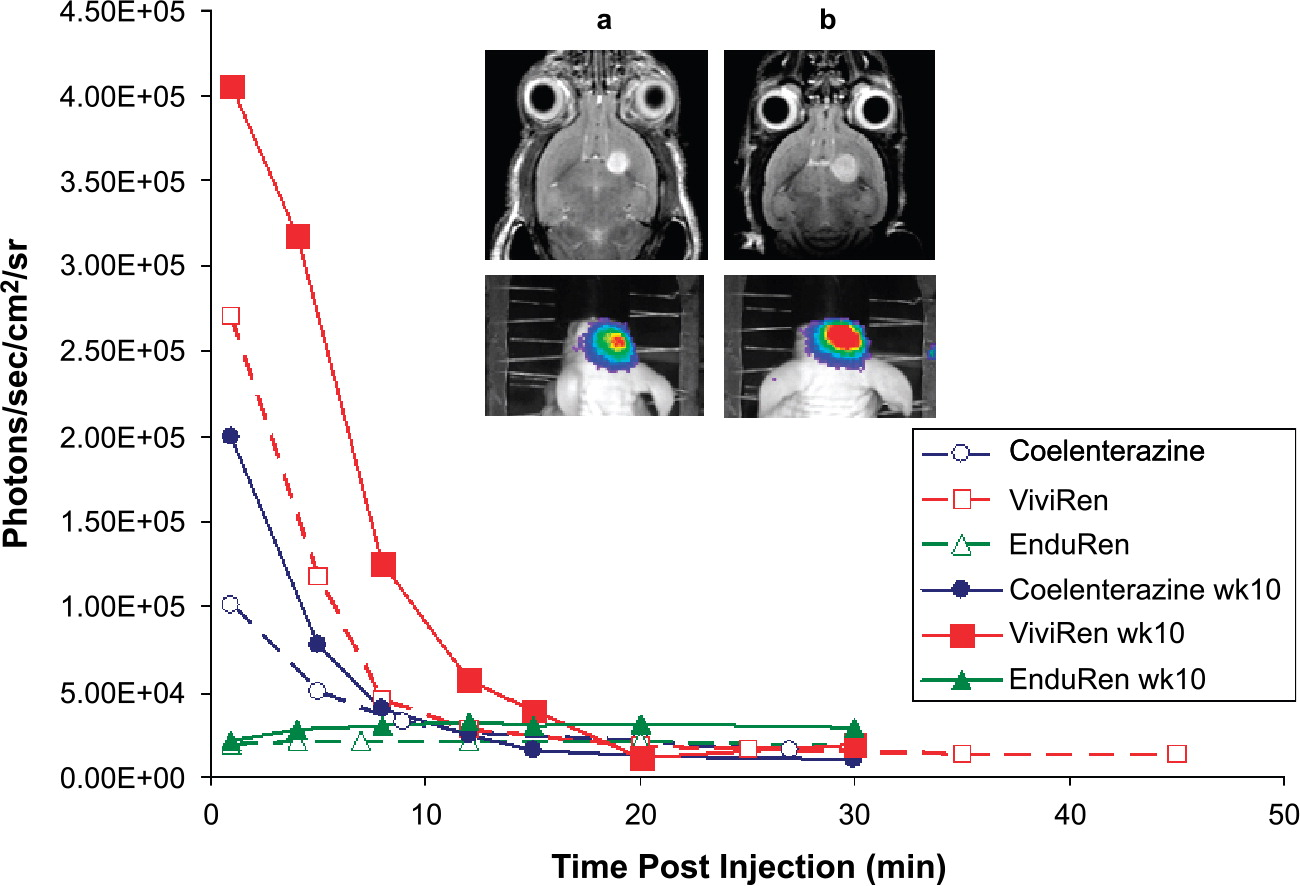
图6:伴随小鼠生长脑中肿瘤海肾荧光信号值产生的变化【5】
EGFP或者mcherry这样的可以吗?可以,当然也可以,但是只能做体表或者眼球这样的浅层成像,我们一直强调肌体是可以吸收蓝绿光波段的波长,很不凑巧EGFP是绿光,如果在体内,提别是深层脏器,损失就更大,所以深层脏器就不要使用这类荧光蛋白了。那有老师会说红光呢?是个不错的选择,但是很多激发波长也是在红绿波段,整体不是很好,不过iRFP713这类的红外荧光蛋白倒是可以获得豁免,他们的激发和发射光都是在红外波段,做成像也是可以的。
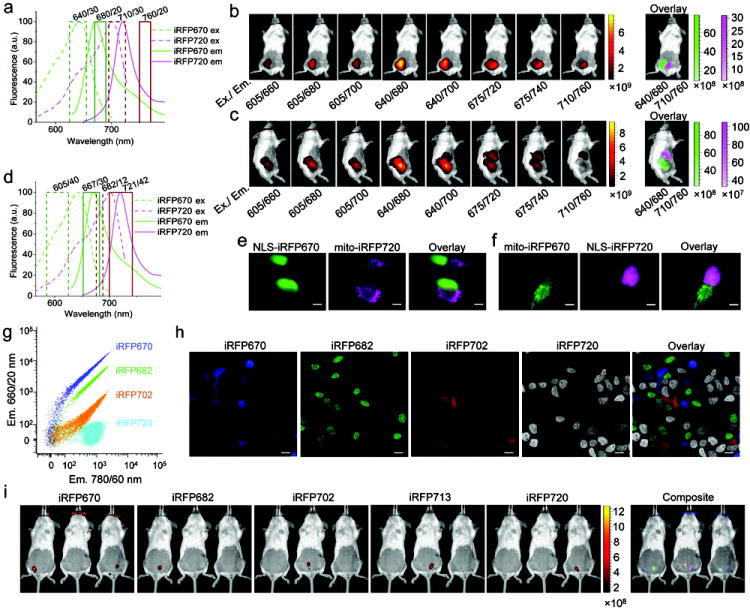
图7:不同IRFP蛋白动物成像强度比较【6】
3.互作类实验:在讨论这个之前,我们先不讨论用什么荧光合适,研究互作往往会用到很多实验,其中用到荧光的实验主要有两类,双分子荧光互补实验(BIFC)或者能量共振转移荧光实验(FRET/BRET),BIFC是将一个荧光蛋白分成两部分,分别构建在需要研究的两个蛋白上,当两个蛋白结合时,分为两半的荧光蛋白得以接近,并且形成一个整体被荧光激发释放出荧光。
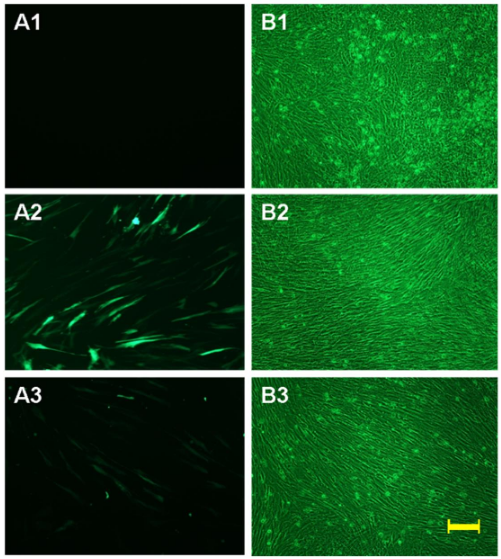
图8:A1阴性对照组未观察到荧光信号,阳性对照组可见强信号,与 pHA-Tf2b 和 pFlag-Tuba1α 质粒共转染的细胞显示荧光信号,这表明 TFIIB 和 α-微管蛋白直接相互作用【7】
这种方式存在一些缺点,比如对于温度比较敏感或者结合需要的时间比较长,并不能实时观测结合情况。那么我们就把目光换到FRET上,相较于前者把一个蛋白分成两个,这种则是使用两种不同荧光的蛋白,分别构建至两个需要研究的蛋白上,然后两者会结合?不不不,这里用到的是另一个原理,在荧光蛋白距离足够接近时,A荧光蛋白的发射光如果在B蛋白的吸收或者说激发波长内,则荧光不发射,而是通过共振的方式传递给B蛋白,这样就可以通过荧光的变化判断两个蛋白之间有没有结合。
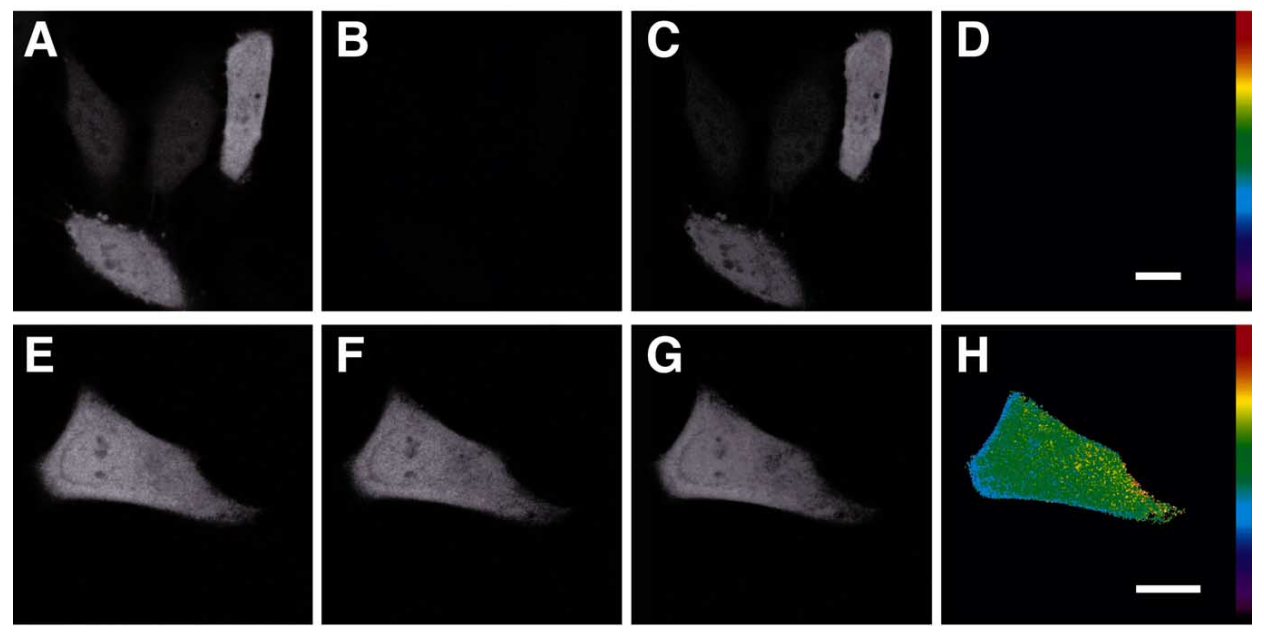
图9:通过活细胞中的敏化发射对FRET进行成像,用 GFP2 和 YFP (A^D) 或
GFP2^YFP 串联构建体并在室温下 16 小时成像【8】
嗯,但是这个方法也不是十全十美的,也是有一些缺点的,比如细胞本身荧光底噪的问题,那解决方案是什么,回忆之前活体成像环节提到的荧光素酶,这类蛋白可以在不被激发的情况下通过酶促底物反应产生光,这个前提下以荧光素酶作为荧光供体,常规荧光蛋白作为受体,就可以通过荧光观察是否有互作了。然而,虽然说这两者都可以研究结合,但是只要距离够近哪怕是不结合也是可以发出需要检测的荧光的,所以一定记得需要设置对照组哦。
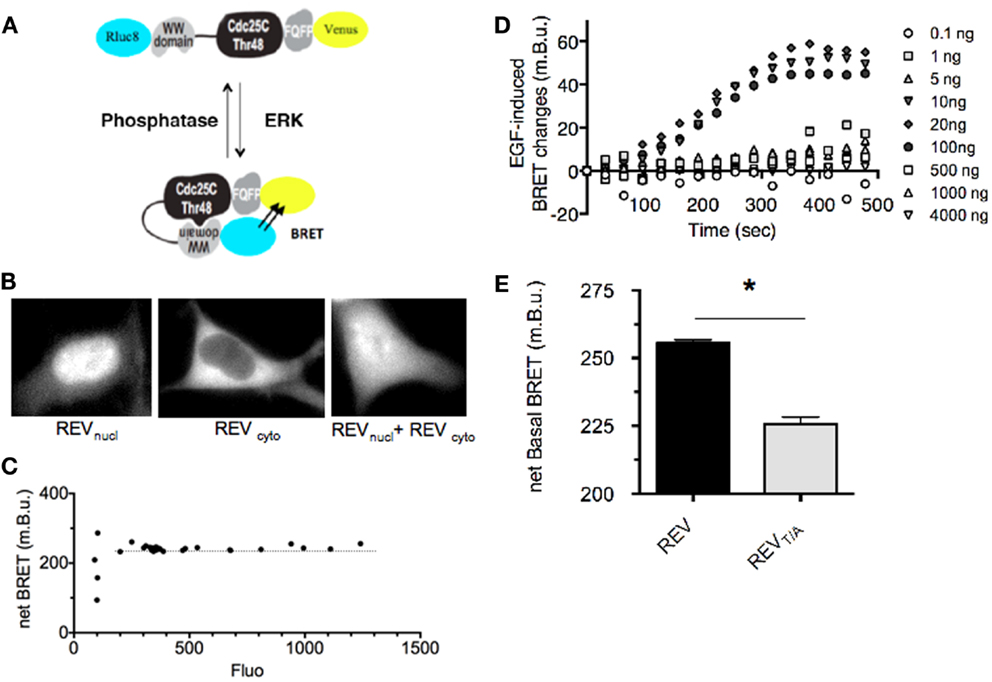
图10:由REV磷酸化诱导的构象改变增加了Rluc8和Venus之间的距离,促进了BRET的增加【9】
4.一些特殊实验对于荧光蛋白的要求:没错,常规实验就是对荧光蛋白类型的要求,对于本本身理化性质要求不大,但是一些特殊的实验却需要特别考虑这一些问题。比如在对缺氧环境下进行荧光标记,或者通过荧光强度反应缺氧条件下一些基因被调控的情况时,常规的EGFP就变的不是那么合适,因为在缺氧的情况下常规的绿色荧光蛋白成熟会被影响,导致无法正常发挥功能,那替换的荧光应该选什么呢,选择UnaG,该蛋白也是绿色荧光,同时可以在低氧的情况下成熟发光,且稳定性也满足实验要求。
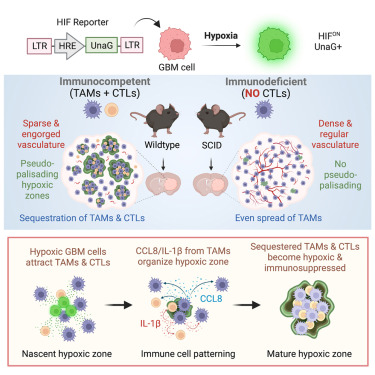
图11:低氧诱导因子激活系统检测示意图【10】
吉凯基因专注于病毒包装,提供质粒,慢病毒,腺病毒,腺相关病毒等多种载体,不知道如何选择?没有关系,登录微信淘基因小程序,浏览产品分类,选择适合实验的载体,选对便于操作的标签。商城上更有多种工具类病毒或者质粒现货可供选择,快捷交付,缩短实验周期,为繁琐的实验提供力所能及的便利。实验从选择开始,吉凯基因——您身边的科研管家。
参考文献…
1. A guide to choosing fluorescent proteins
2.Detection of apoptosis induced by new type gosling viral enteritis virus in vitro through fluorescein annexin V-FITC/PI double labeling
3.Endophilin B2 promotes inner mitochondrial membrane degradation by forming heterodimers with Endophilin B1 during mitophagy
4. Noninvasive Visualization of MicroRNA-16 in the Chemoresistance of Gastric Cancer Using a Dual Reporter Gene Imaging System
5. In Vivo Testing of Renilla Luciferase Substrate Analogs in an Orthotopic Murine Model of Human Glioblastoma
6. Near-infrared fluorescent proteins for multicolor in vivo imaging
7. TFIIB Co-Localizes and Interacts with α-Tubulin during Oocyte Meiosis in the Mouse and Depletion of TFIIB Causes Arrest of Subsequent Embryo Development
8. Spectral imaging and linear un-mixing enables improved FRET efficiency with a novel GFP2–YFP FRET pair
9. REV, a BRET-based sensor of ERK activity
10. Hypoxic niches attract and sequester tumor-associated macrophages and cytotoxic T cells and reprogram them for immunosuppression
