作为中脑皮层边缘回路中的主要区域,腹侧被盖区(VTA)参与调节与奖赏相关的动机、厌恶和认知行为。VTA区的谷氨酸能神经元会投射至腹侧纹状体(NAc)、外侧僵核或者腹侧苍白球,其中VTA中包含多巴胺能、GABA能、谷氨酸能神经元等多种类型的神经元[1-2]。实验表明,光遗传学激活VTA谷氨酸能神经元除了会引起奖赏相关的强化行为之外,还能引起回避行为,但其具体的机制尚不清楚[3-4]。
近期神经科学领域著名期刊Neuron上刊发了加州大学圣地亚哥分校Thomas S. Hnasko实验室题为Mesoaccumbal glutamate neurons drive reward via glutamate release but aversion via dopamine co-release的研究工作,揭示了VTA-NAc神经环路可同时引起奖赏和厌恶行为的机制,阐明了VTA谷氨酸神经元释放的谷氨酸具有积极的强化作用,但VTA谷氨酸神经元释放的多巴胺引发回避行为的现象[5]。

由于谷氨酸能神经元会同时释放谷氨酸和多巴胺,为控制单一变量,研究者们首先对谷氨酸和多巴胺的释放进行了干预。他们通过向VTA注射AAV1-FLEX-SaCas9-U6-sgROSA26 (对照组), AAV1-FLEX-SaCas9-U6-sgVGLUT2(谷氨酸敲低组), AAV1-FLEX-SaCas9-U6-sgTh(多巴胺敲低组)病毒(图1A,B),使用CRISPR-Cas9技术结合VGLUT2:Cre工具小鼠分别特异性敲除VTA兴奋性神经元的VGLUT2和TH(合成多巴胺的酪氨酸羟化酶),实现特异性降低谷氨酸或多巴胺的释放(图1E-H)。
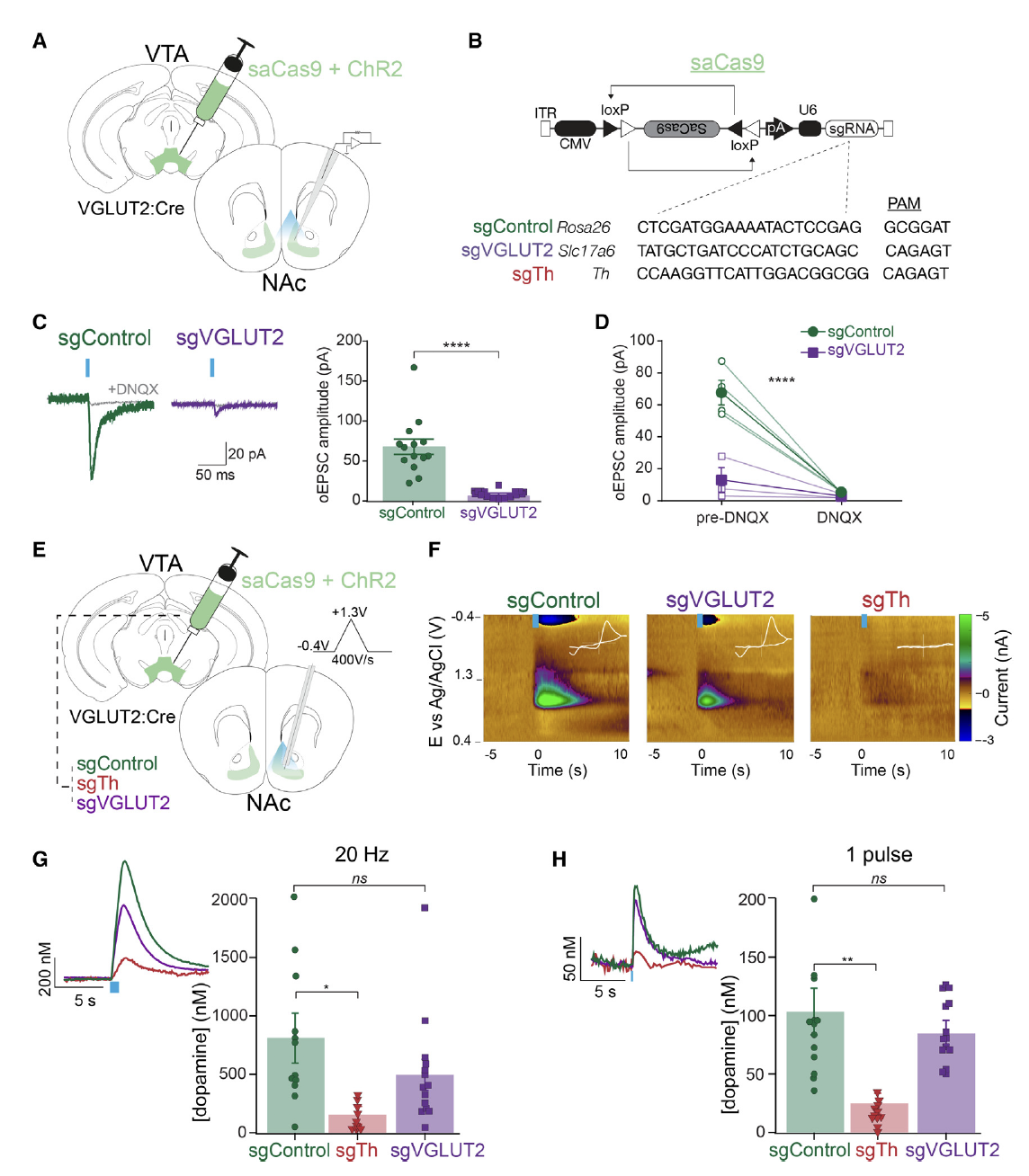
图1. CRISPR-Cas9技术结合Cre动物实现对多巴胺和谷氨酸的特异性干预
先前的研究表明,老鼠会通过捅鼻子来获得VTA谷氨酸神经元的光遗传学刺激,并产生偏好性强化[3],该实验为颅内自刺激触鼻实验(图2A-C)。于是研究者们在特异性敲低谷氨酸和多巴胺的动物上重复颅内自刺激触鼻实验,并对其行为进行观察。研究结果显示,敲低谷氨酸后小鼠触碰激活按钮次数明显减少,且不表现出偏好性,说明谷氨酸可能介导了VTA脑区兴奋性神经元编码正向强化的过程(图2D-G)。
为监测VTA中谷氨酸对回避行为的作用,研究者们同样借助CRISPR-Cas9技术结合VGLUT2:Cre工具小鼠特异性敲除VTA兴奋性神经元的VGLUT2敲低谷氨酸的释放,并观察条件性厌恶实验模型中小鼠的行为(图3A)。结果显示敲低谷氨酸后(图中的sgVGLUT2组)小鼠对有光刺激一侧的偏好性并不受影响,因此说明VTA谷氨酸能神经元释放的谷氨酸并不参与调控厌恶行为(图3B-F)。
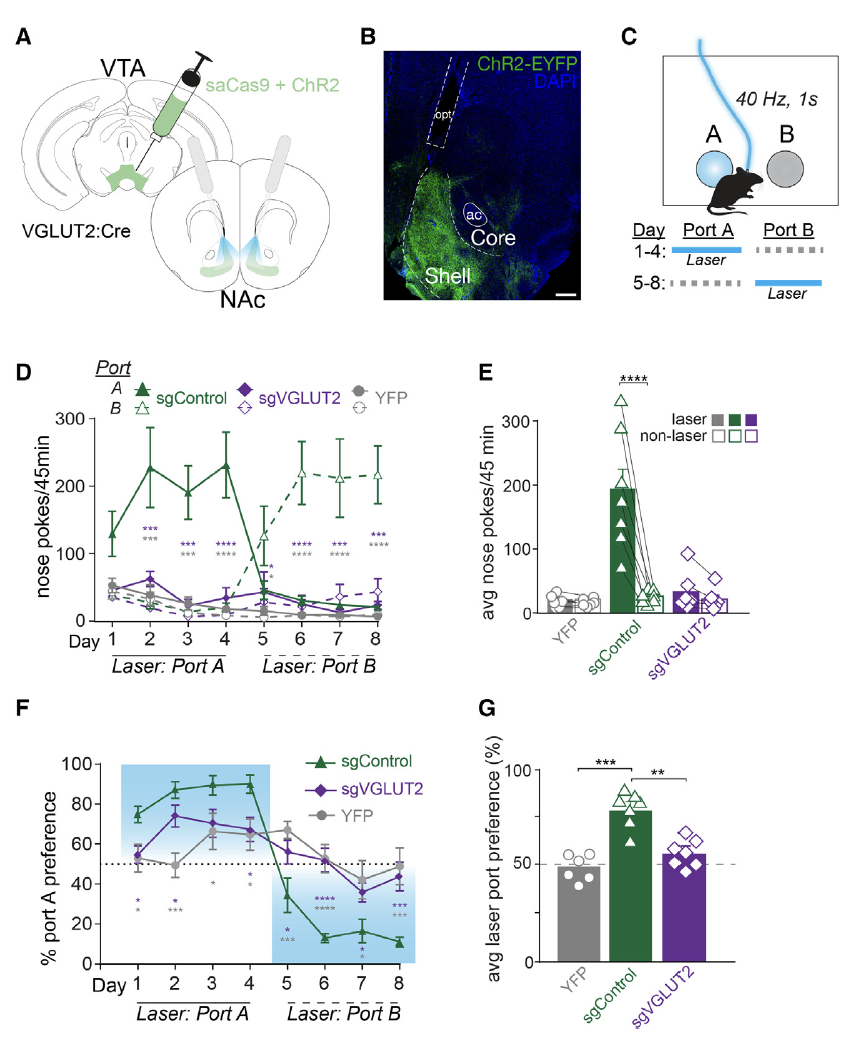
图2. 谷氨酸调控VTA-NAc介导的正向强化行为
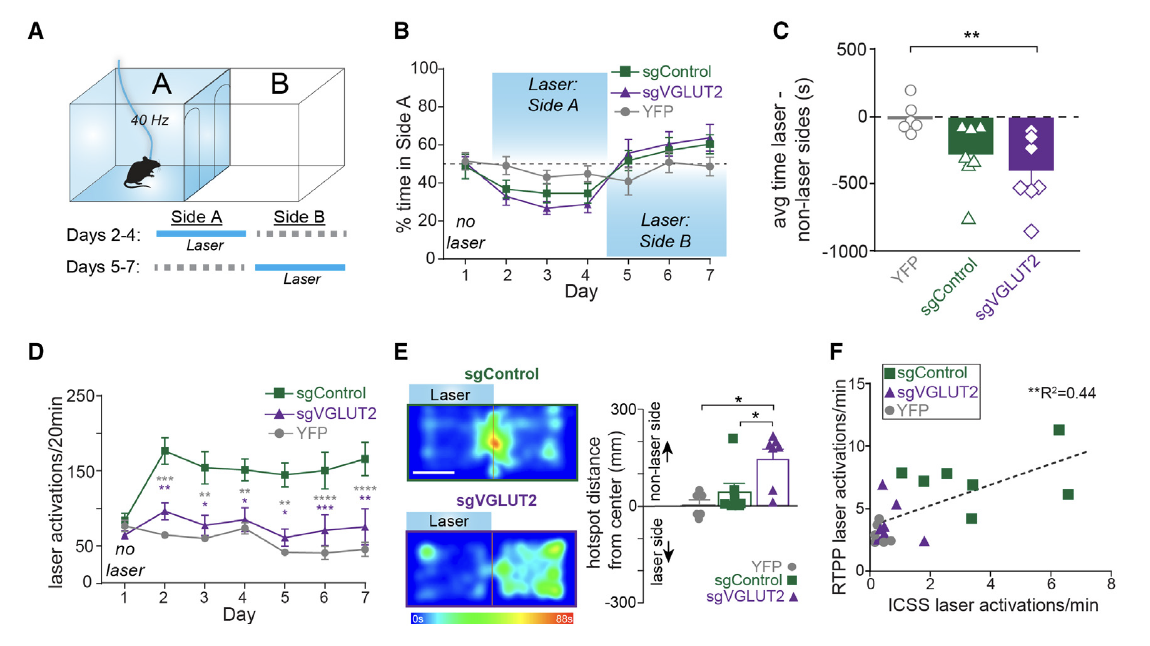
图3. 谷氨酸不调控VTA-NAc介导的厌恶行为
接下来研究者们对VTA兴奋性神经元中多巴胺的作用进行了研究。研究者们同样用CRISPR-Cas9技术向VGLUT2:Cre小鼠的VTA注射AAV1-FLEX-SaCas9-U6-sgTh病毒敲低VTA区多巴胺的释放。在可以反映强化行为的颅内自刺激触鼻实验中,敲除多巴胺的动物并没有表现出对激活按钮的偏好,说明仅敲低多巴胺不影响VTA-NAc介导的正向强化行为。但同时敲低多巴胺和谷氨酸的组对激活按钮的偏好消失了,说明谷氨酸参与介导正向强化行为(图4E-G)。
研究者们同样还研究了多巴胺对回避行为的作用。在条件性厌恶实验中,敲低多巴胺组和同时敲低多巴胺和谷氨酸组的动物没有表现出对地点的回避与偏好(图4H-I),但敲低多巴胺组的动物进入激光一侧的次数增加(图4J-K)。这些结果表明VTA谷氨酸能神经元的多巴胺共释放介导了回避行为,而谷氨酸则促进正性强化行为。
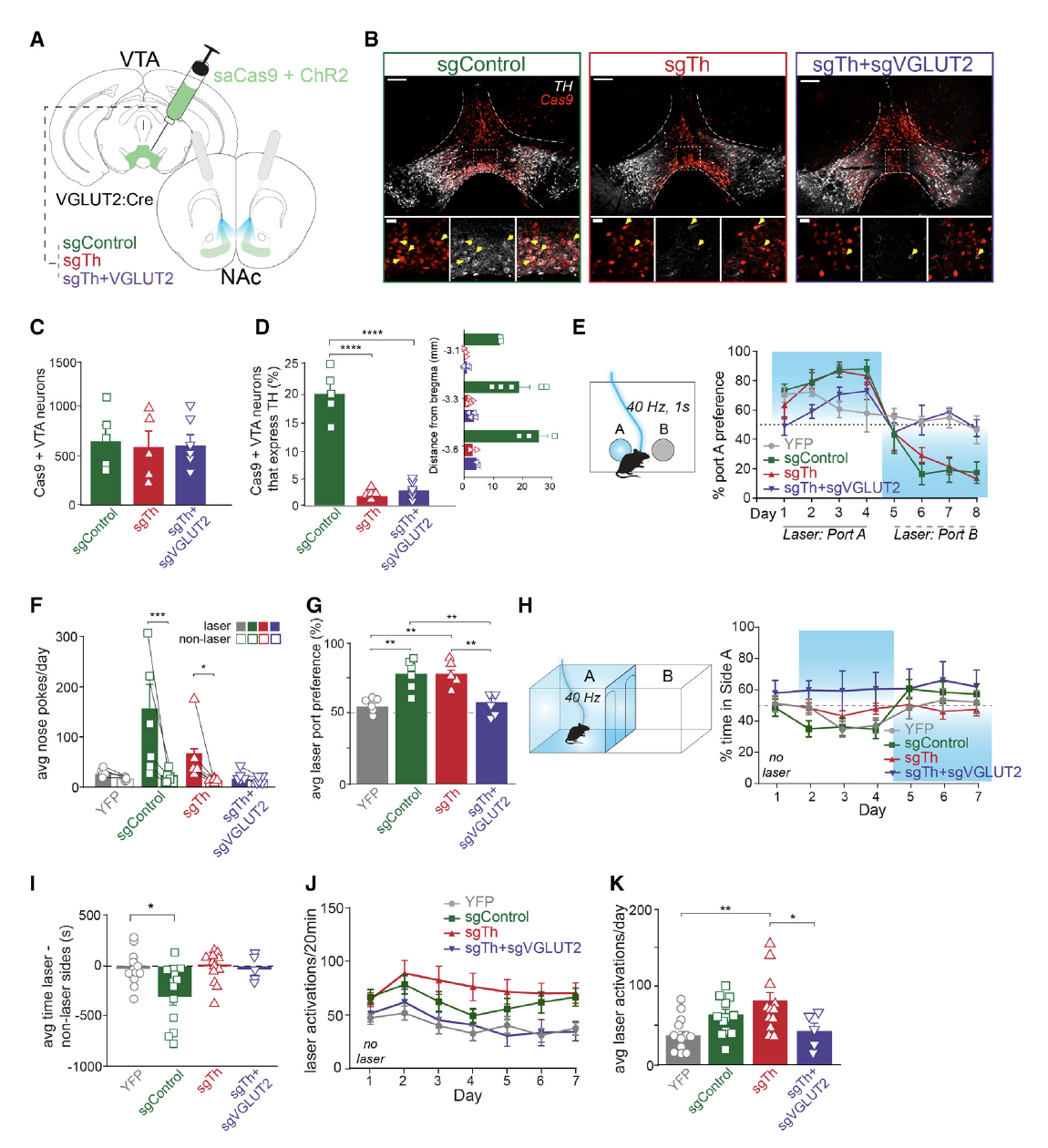
图4. VTA多巴胺雨谷氨酸共释放介导回避行为
综上,这项研究表明VTA谷氨酸神经元通过释放谷氨酸促进正性强化,同时通过多巴胺和谷氨酸的共释放诱发回避行为。这一证据进一步突显了VTA在正向强化过程中的贡献并扩展了领域内对于共释放群体中神经递质特定角色的理解,对于理解涉及强化和回避行为的疾病具有深刻的意义。
参考文献…
[1] Pupe, S., and Walle´ n-Mackenzie,A . (2015). Cre-driven optogenetics in the heterogeneous genetic panorama of the VTA. Trends Neurosci. 38,375–386.
[2] Eskenazi, D., Malave, L., Mingote, S., Yetnikoff, L., Ztaou, S., Velicu, V.,Rayport, S., and Chuhma, N. (2021). Dopamine neurons that cotransmit glutamate, from synapses to circuits to behavior. Front. Neural Circuits 15, 665386.
[3] Yoo, J.H., Zell, V., Gutierrez-Reed, N., Wu, J., Ressler, R., Shenasa, M.A.,Johnson, A.B., Fife, K.H., Faget, L., and Hnasko, T.S. (2016).Ventral tegmental area glutamate neurons co-release GABA and promote positive reinforcement. Nat. Commun. 7, 13697.
[4] Zell, V., Steinkellner, T., Hollon, N.G., Warlow, S.M., Souter, E., Faget, L., Hunker, A.C., Jin, X., Zweifel, L.S., and Hnasko, T.S. (2020). VTA glutamate neuron activity drives positive reinforcement absent dopamine co-release. Neuron 107, 864–873.e4.
[5] Warlow SM, Singhal SM, Hollon NG, Faget L, Dowlat DS, Zell V, Hunker AC, Zweifel LS, Hnasko TS. (2023) Mesoaccumbal glutamate neurons drive reward via glutamate release but aversion via dopamine co-release. Neuron 112,1-12.
