沈阳药科大学孙进、何仲贵与新加坡国立大学陈小元、倪倩倩合作在Nature Communications发表文章。作者精心构建了一个能够预防全身副作用并激活抗肿瘤免疫的细胞因子传递平台。凭借出色的安全性和完善的制造工艺,仿生纳米疫苗在改善IL-15向淋巴结的靶向递送方面展现出巨大的前景。从机制上讲,作者已经证明了其以多价方式介导IL-15反式呈递并激活强大的肿瘤特异性CTL反应。传统的细胞因子治疗常常会因非肿瘤特异性T细胞的全身激活而引起剂量限制性毒性。这种方法可以通过多价IL-15自反式呈递 (MIST) 和肿瘤抗原呈递的时空整合诱导更安全、更有效的针对肿瘤的CTL免疫反应,从而彻底改变传统的细胞因子疗法。这种策略增强了肿瘤特异性T细胞反应,显著增强治疗效果,促进肿瘤清除,并提高持久的免疫记忆。鉴于细胞膜囊泡对天然蛋白质插入的耐受性,该策略为细胞因子递送提供了一种通用的方法。尽管细胞膜囊泡制剂的生产过程有些复杂,但细胞膜囊泡的生产和质量控制并不是主要障碍,因为作者已经为细胞膜囊泡的放大制备制定了标准,并进行了适当的质量控制。

传统的IL-15治疗很可能与淋巴结中数量较多的非肿瘤特异性T细胞结合,导致治疗效果不理想且副作用严重。相反,biNV-IL-15会靶向肿瘤特异性T细胞,同时递送多价IL-15和肿瘤抗原,专门刺激肿瘤特异性T细胞激活,提高治疗效果并防止副作用。作者探索了biNV-IL-15对初始CD8+ T细胞的启动效果。收集脾脏CD8+ T细胞并用不同的制剂孵育。从4T1或CT26肿瘤组织中分别提取HCP作为肿瘤抗原制备biNV-IL-15,并通过多步密度梯度超速离心从未经处理的BMDC制备DC囊泡。biNV可以刺激CD8+ T细胞产生更高水平的IFN-γ和TNF-α,导致T细胞介导的针对4T1和CT26肿瘤细胞的溶解效率更高。

图1. 仿生疫苗介导IL-15自呈递
IL-15的体内反式呈递依赖于其有效递送至淋巴器官。然而,快速的全身清除和次级淋巴器官保留不足仍然是IL-15临床应用的主要障碍。在该研究中,作者用Cy-7标记IL-15和biNV-IL-15,并研究了它们静脉给药后的药代动力学和生物分布特性。IL-15-Cy7迅速从血液循环中消除,半衰期(t1/2)为0.69小时。令人鼓舞的是,biNV-IL-15-Cy7显示出较长的循环时间,t1/2约为5.66小时。与游离IL-15-Cy7相比,biNV-IL-15-Cy7的AUC升高约 6.6 倍。biNV-IL-15-Cy7在腋窝和腹股沟淋巴结表现出比IL-15-Cy7高12.3倍和15.3倍的药物积累。
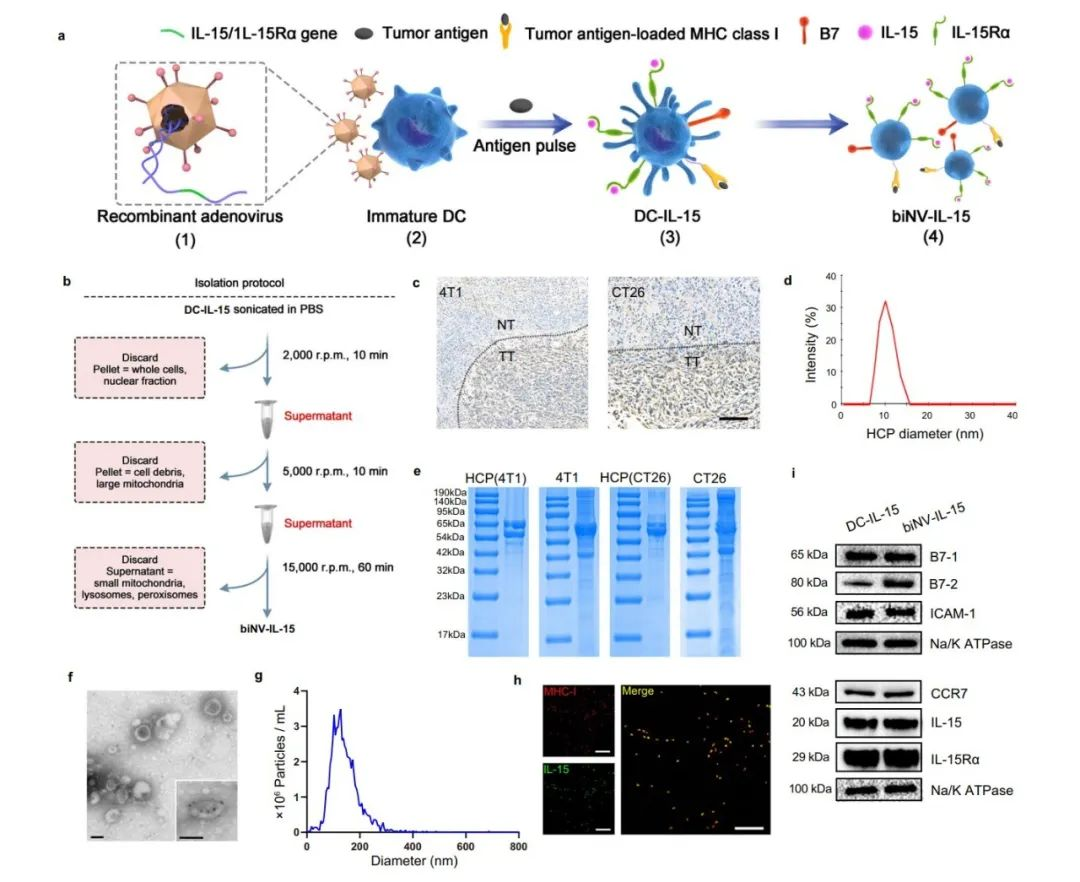
图2. biNV-IL-15合成
接下来,作者研究了biNV-IL-15的体内毒性。健康小鼠按照梯度给药方案接受 IL-15 和 biNV-IL-15 治疗。四次注射 IL-15(单次治疗剂量超过7.5 μg)后观察到体重显著下降,最终导致致命的免疫毒性。相比之下,即使在最大可用注射剂量(相当于10 μg IL-15)下,biNV-IL-15的治疗也没有出现明显的毒性。此外,作者测试了用不同制剂治疗的小鼠的血清生化参数和血液学参数,多价IL-15自反式呈递在可达到的最大剂量下仍能保持生物标志物的基础水平。
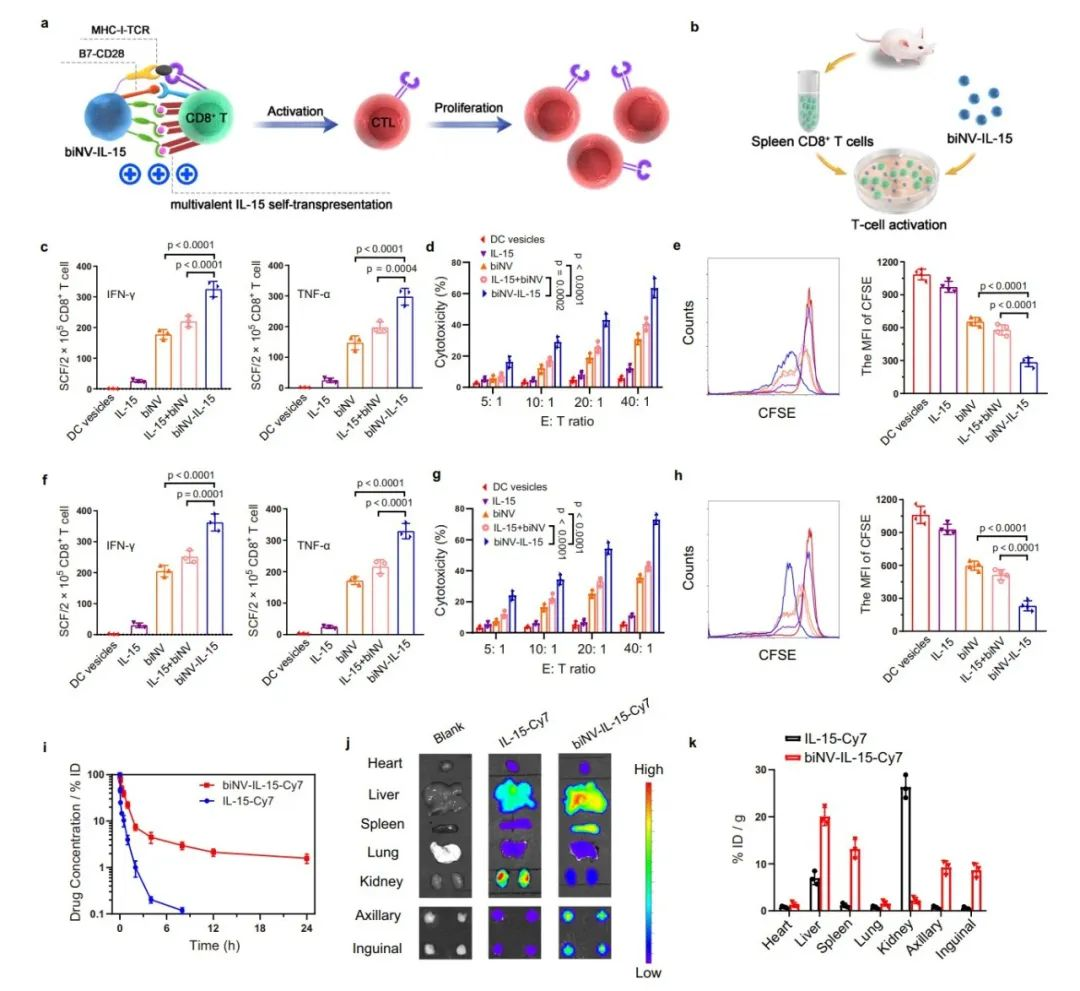
图3. IL-15的自呈递
作者进一步研究了biNV-IL-15在不同肿瘤模型中的抗肿瘤活性。PBS和DC囊泡治疗均未表现出抗肿瘤作用,IL-15略微延迟了肿瘤生长。而biNV表现出改善的肿瘤抑制功效和延长的生存期,表明仿生纳米疫苗介导的肿瘤抗原呈递具有潜在的治疗作用。与IL-15+biNV相比,biNV-IL-15表现出显著增强的抗肿瘤活性并延长了生存期。
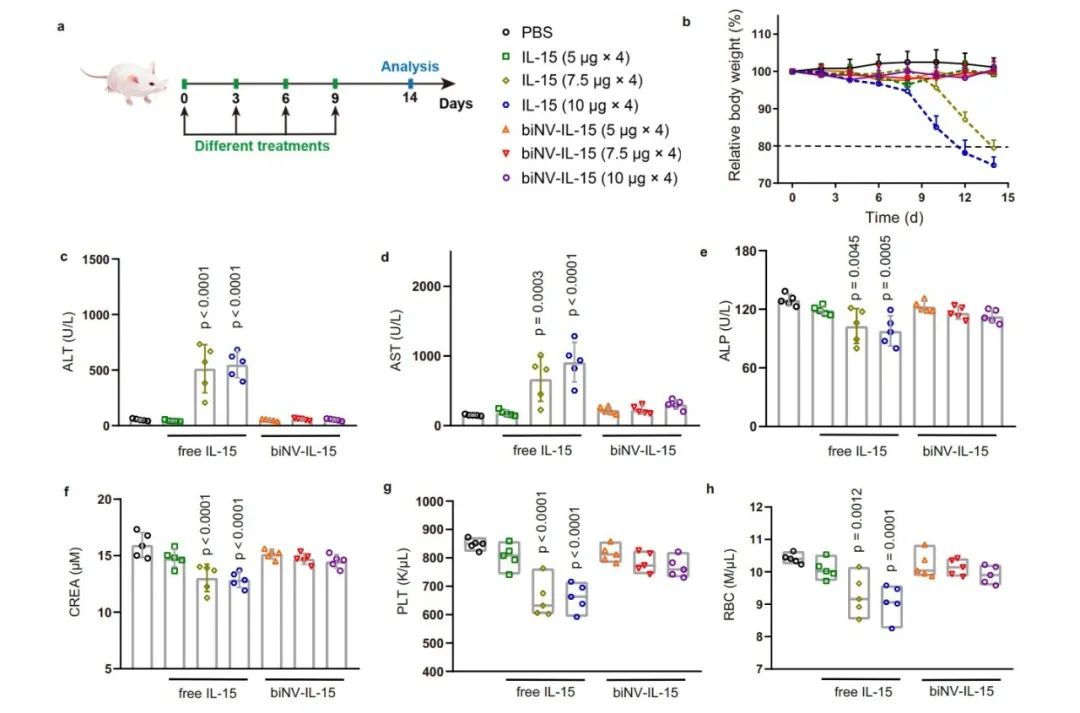
图4. 提升的IL-15治疗窗
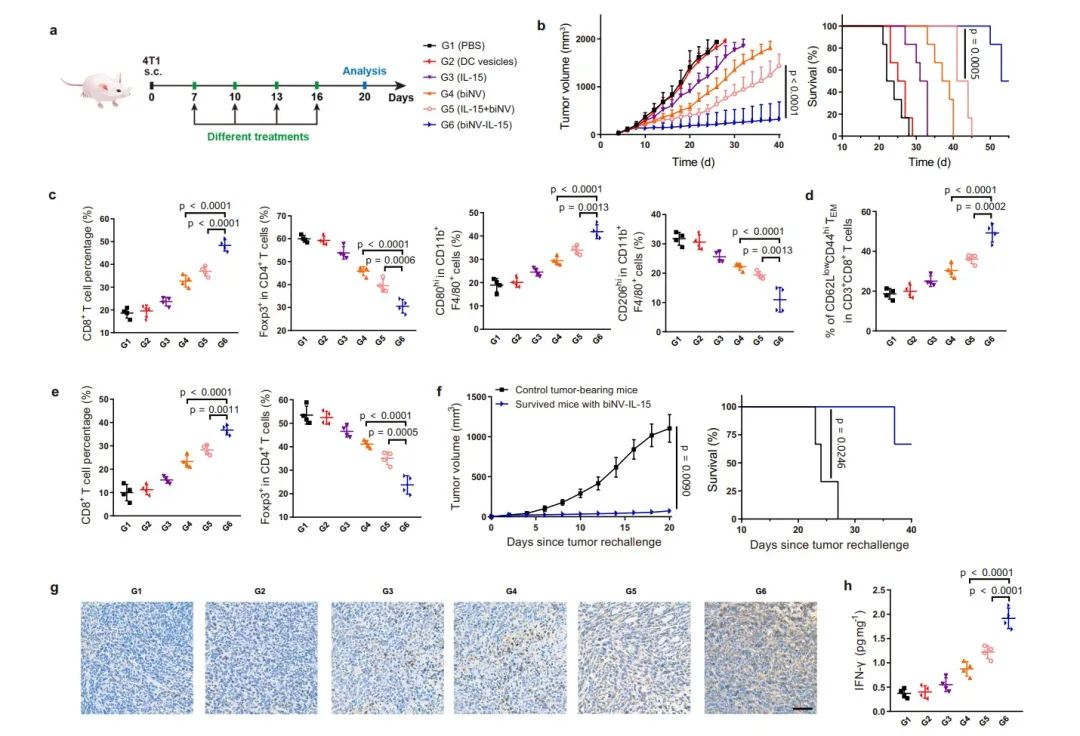
图5. 体内抗肿瘤疗效
吉凯助力:
本文IL-15和IL-15Rα编码的重组腺病毒由吉凯基因提供,助力高水平的科学研究。
作者简介:
沈阳药科大学孙进、何仲贵与新加坡国立大学陈小元、倪倩倩是本文的通讯作者。
