在遇到不同的外界环境刺激时,大脑神经网络能够迅速评估内部状态和外部环境,从而果断地选择最佳选项,但是在食物诱惑和被捕食风险同时存在时,动物会被迫做出选择[1-2]。为了准确地检测、定位和识别即将到来的威胁,动物会依靠传入的感觉信息做出一系列防御行为[3]。自我保护对于猎物来说至关重要,因为它们通常被迫离开安全的居所,寻找必要的卡路里以确保生存。在被捕食和获取食物之间进行的这种交流需要大脑实时估计、计算和协调的行动来优化行为[4]。基于此理论,科学家们提出一种捕食风险分配假设预测,动物会在与捕食暴露的时间变化相关的觅食努力和警惕性之间进行权衡,从而在满足能量需求的同时最大程度地减少受伤或被杀的风险。但很少有研究证实了这一理论,支撑这种权衡背后的神经机制仍然难以捉摸。
近日,美国国立卫生研究院的Michael J. Krashes实验室在Neuron发表了题为Toggling between food-seeking and self-preservation behaviors via hypothalamic response networks的工作,阐明了小鼠决策行为背后的神经生物学机制[5]。

小鼠在面临危险时,会由于危险信号引起许多外周和中枢防御反应。为了研究小鼠的反应,研究者们分别放置了一个大鼠玩偶和一只饥饿的大鼠(可视为捕食者)在小鼠的附近(图1A)。研究结果显示相较于对照组而言,捕食者的刺激会引起小鼠粪便排泄增多(图1B)、静止时间增多(图1C),这些都是小鼠在应激/恐惧状态下会显示出的两种本能行为反应。血液样本的结果显示面对捕食者的小鼠的应激激素皮质酮水平比暴露于填充动物的同龄和性别匹配对照组更高(图1D)。
由于下丘脑-垂体-肾上腺轴中皮质酮是由下丘脑室旁核(PVH)中的皮质释放激素(CRH)神经元分泌的,因此研究者们通过Cre依赖的方式向PVH注射了AAV-hSyn-FLEX-GcaMP6s的病毒(图1E),实验结果显示捕食者使得小鼠PVHCRH持续性激活(图1F)。

图1: 捕食者会引起小鼠生理、行为及神经变化
为了评估自我保护机制与热量需求之间的交集,研究者们在经过过夜禁食的小鼠中进行了饲养行为评估,分别在1)空笼子;2)大鼠玩具;3)TMT;4)大鼠捕食者;这四种情况下观察小鼠对食物的摄取(图2A)。研究结果显示在高危险的情况下小鼠对食物的摄取明显减少,但在危险消失后,小鼠会恢复进食(图2B)。

图2:捕食者环境会减少饥饿小鼠对食物的探索和消耗
为了进一步评估小鼠的选择行为,研究者们通过改变动物的内部状态(饱腹Sated或者禁食Fasted)或移动FED的位置来最小化这些冲突(图3A)。当在威胁区域(TZ)测试饱腹(Sated)的小鼠时,所摄取的颗粒数量进一步减少(图3B),然而,当FED被重新放置在鼠笼的另一侧安全区(SZ)的隐藏墙后面时,饥饿的小鼠的食物摄入量增加(图3B)。减少卡路里需求或减弱潜在威胁明显地改变了小鼠的进食模式。饥饿-S小鼠的进食速率比饥饿-TZ和饱腹-TZ条件下的小鼠更高,获取第一个食物颗粒的潜伏期更短(图3C–3E)。这说明小鼠的进食模式会随着潜在危险的变化而改变。
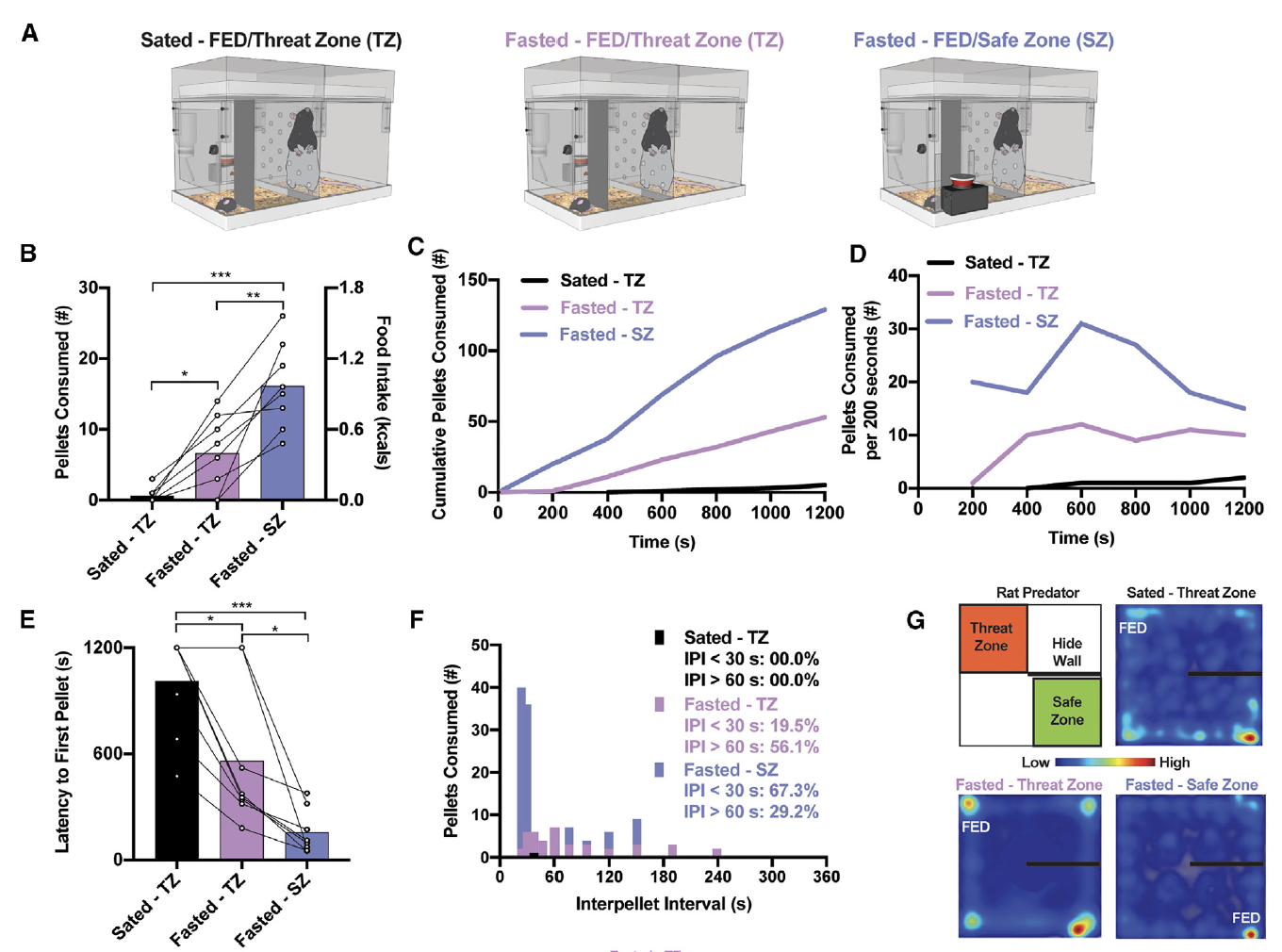
图3:小鼠摄食行为会因卡路里需求量和环境变化而改变
前期的这些实验表明,老鼠捕食者的存在抑制了进食行为。考虑到AgRP神经元在介导觅食和摄食方面的作用,研究者们假设暴露于威险可能会抑制这些细胞。为了证实这种可能性,研究者们在只在AgRP/神经肽Y(NPY)标记的神经元中表达绿色荧光蛋白(GFP)的饥饿小鼠中,对Fos蛋白进行了共染色。饥饿的动物在存在捕食者的环境下,AgRP/Fos细胞的共标记水平明显低于暴露于玩具大鼠环境的动物,且后者的条件未能改变摄食行为(图4A–4C)。这表明AgRP的抑制可能是导致在老鼠捕食者存在时观察到的摄食行为减少的潜在机制。
为了在体内测试这一点,研究者们通过AAV-FLEX-GcaMP6s病毒定向的将GCaMP表达在饥饿小鼠的ARC中,并记录了AgRP神经元的动态变化(图4D和4E)。虽然在没有食物的情况下加入玩具大鼠对神经元活动没有影响,但老鼠捕食者的存在降低了AgRP网络反应(图4E–4F)。这些实验表明,老鼠捕食者的威胁能够降低饥饿动物中AgRP的活动,可能有助于在危险情况下阻碍摄食行为。
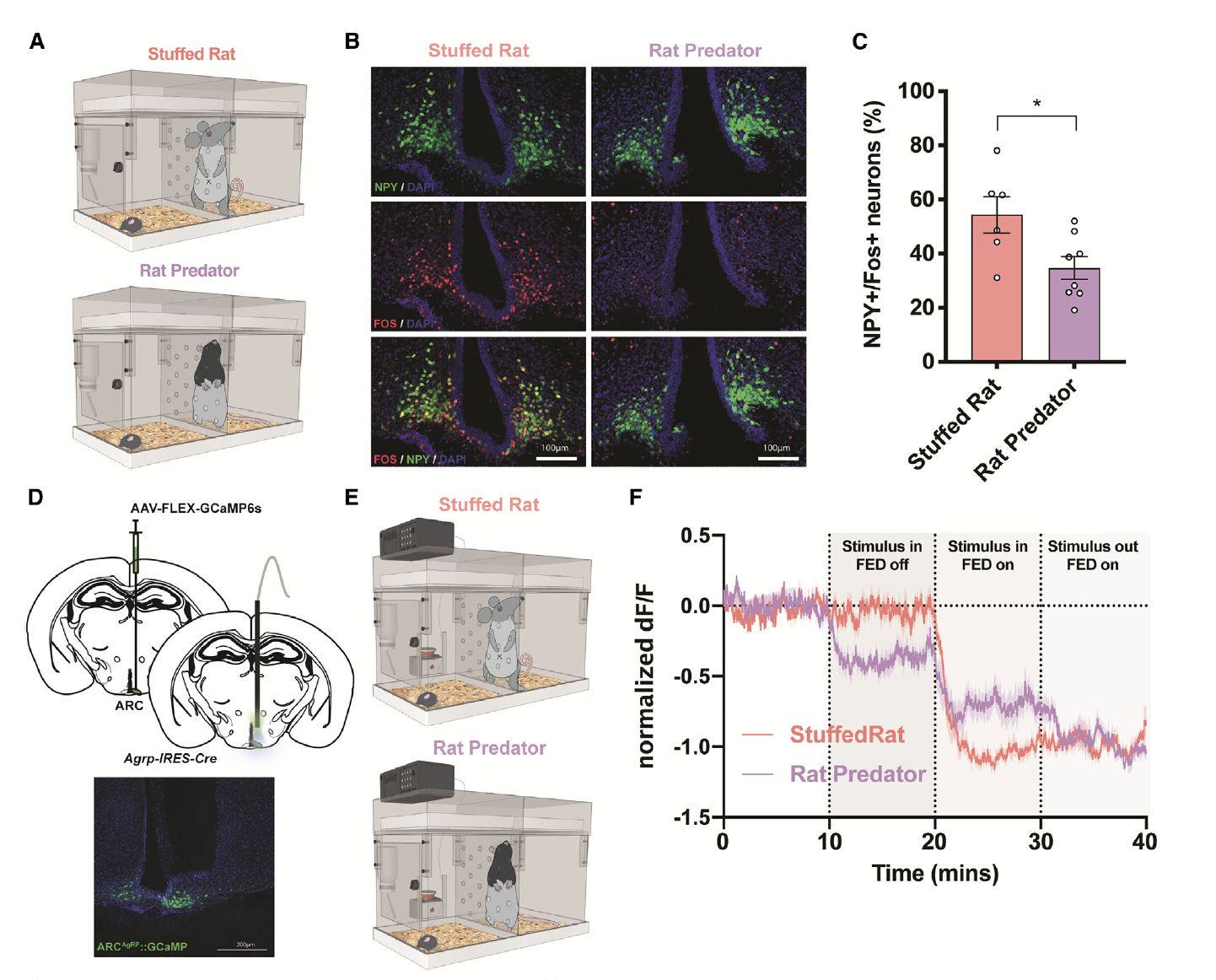
图4: 在大鼠捕食者出现时,AgRP活性减弱
接下来,研究者们试图通过TRAP技术来确定大鼠捕食者引起改变的脑区,于是他们将重点放在下丘脑的防御网络上。在PMd中,有一个表达Cck的神经元亚群,最近已被证明对急性威胁做出反应(图5A)。因此通过基于AAV-FLEX-hM4Di-mCherry的化学遗传学技术抑制PMdCck活性后(图5C),观察到即使是在捕食者存在的情况下,小鼠对食物的摄取也会显著增加(图5D、E)。类似的,通过基于AAV-FLEX-ChR2-tdTomato的光遗传学技术激活PMdCck活性后(图5F),小鼠对食物的摄取显著减少(图5G-I)这些结果表明,PMdCck神经元在威胁应答和调节摄食行为方面发挥了关键作用,这些神经元在危险情况下会阻碍寻食。

图5: PMdCck神经元调控危险存在时小鼠的进食行为
为了直接确认PMdCck信号对于威胁诱导的AgRP/NPY活动抑制的必要性,他们分别使用AAV-FLEX-hM4Di-mCherry和AAV-hSyn-fDIO-GcaMP6s同时靶向了PMdCck和AgRP/NPY细胞(图6G)。与激活实验的结果不同,抑制PMdCck神经元对AgRP/NPY群体动态没有影响(图6H)。此外,PMdCck抑制未能改变老鼠捕食者引发的AgRP/NPY活动抑制(图6H和6I),这表明存在其他途径使得小鼠优先考虑自我保护而不是寻找食物。
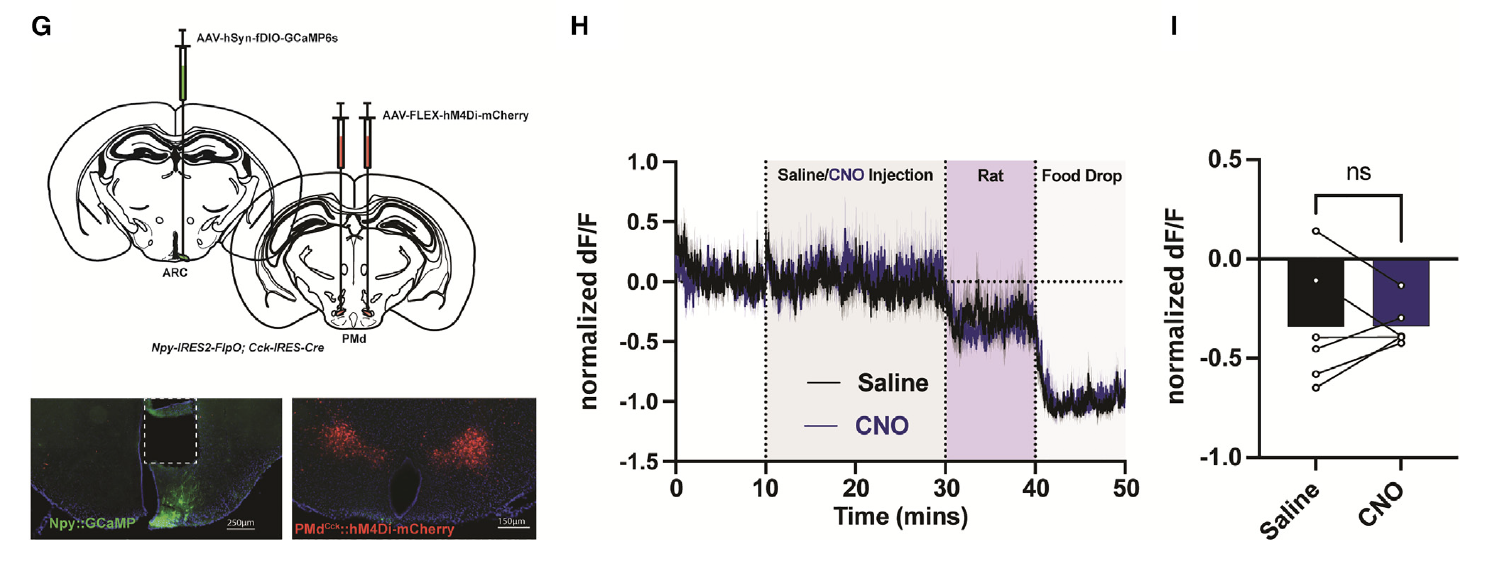
图6: PMdCck神经元通过抑制AgRP/Npy调控摄食行为
最后研究人员接着研究了AgRP神经元在尤其是在涉及实时决策成本和效益的情境下调节进食行为中的作用。他们使用化学遗传学技术抑制AgRP神经元,在有或没有捕食者的条件下都减少了饥饿小鼠的食物摄入量,证实了之前的实验结果(图7C和7D)。此外,研究人员还探讨了激活AgRP神经元对食物摄入的影响。为了在捕食者存在的情境中探索这一现象,研究人员向ARC注射AAV-FLEX-ChR2-tdTomato的病毒,选择性地激活AgRP神经元(图7E),结果显示饥饿小鼠对食物摄取显著增加,但饱食的小鼠中没有观察到明显的摄食增多现象(图7F),这可能是由于在存在食物的情况下持续激活AgRP神经元对于正常生理的非自然干预性质引起的。
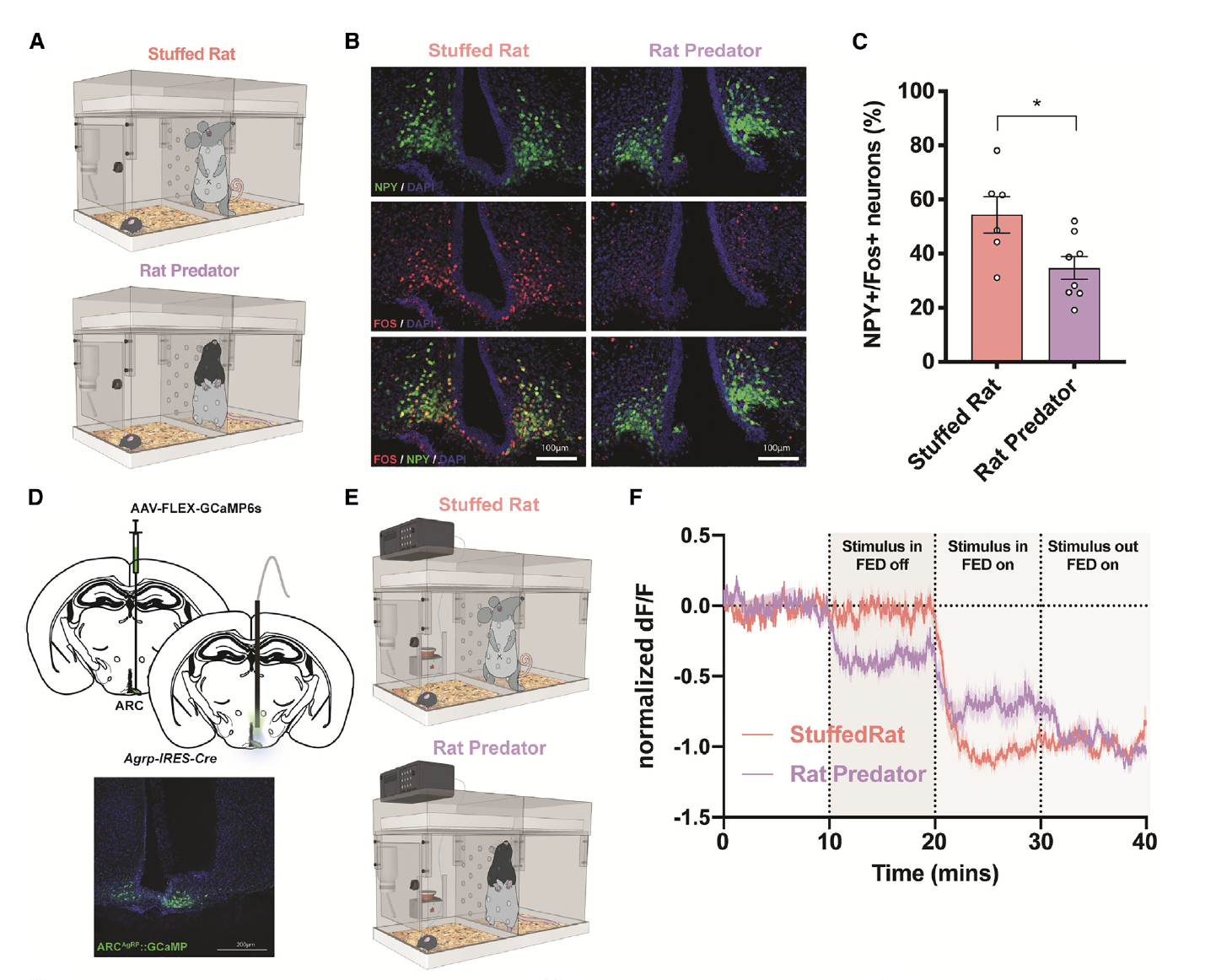
图7: 危险环境下的摄食行为受小鼠自身状态的影响,并由AgRP神经元介导
在自然界中,多个系统通过复杂的神经网络相互竞争,以表达目标导向的行为。在这项研究中,de Araujo Salgado研究了了在面临捕食威胁时寻求食物的动物所做出的灵活的生存决策。他们发现,捕食者的出现迅速引发了小鼠的生理、神经和行为适应,表现为食物寻求和消耗的减少。他们发现通过调整内部状态或外部环境干扰来减少冲突可以改变摄食策略,并证实了PMdCck神经元和AgRP神经元在该行为当中的重要作用。
参考文献…
向上滑动阅览
[1] Grillner, S., Hellgren, J., Me´ nard, A., Saitoh, K., and Wikstro¨ m, M.A. (2005). Mechanisms for selection of basic motor programs–roles for the striatum and pallidum. Trends Neurosci. 28, 364–370. https://doi.org/10.1016/j. tins.2005.05.004.
[2] Flavell, S.W., Gogolla, N., Lovett-Barron, M., and Zelikowsky, M. (2022). The emergence and influence of internal states. Neuron 110, 2545–2570. https://doi.org/10.1016/j.neuron.2022.04.030.
[3] Levine, D.N. (2007). Sherrington’s ‘‘the integrative action of the nervous system’’: a centennial appraisal. J. Neurol. Sci. 253, 1–6. https://doi.org/10.1016/j.jns.2006.12.002.
[4] Dent, C.L., Isles, A.R., and Humby, T. (2014). Measuring risk-taking in mice: balancing the risk between seeking reward and danger. Eur. J.Neurosci. 39, 520–530. https://doi.org/10.1111/ejn.12430.
[5] de Araujo Salgado et al., Toggling between food-seeking and self-preservation behaviors via hypothalamic response networks, Neuron (2023), https://doi.org/10.1016/j.neuron.2023.06.006.(原文)
