病毒载体是以病毒为基础的基因载体,是一种常见的分子生物学工具,利用病毒载体可将目的基因传递至培养的细胞或是完整活体中。
用于基因导入并能在临床开展研究的病毒载体一般应具备以下基本条件:
①携带外源基因并能包装成病毒颗粒;
②介导外源基因的转移和表达;
③对人体不致病;
④在环境中不会引起增殖和传播。
常用的病毒载体有腺病毒、慢病毒及腺相关病毒(AAV)。3种病毒载体的区别如下:
腺病毒是一种无包膜的双链DNA病毒,在自然界中广泛分布。完整的病毒颗粒为二十面体对称结构,直径70-100nm,衣壳含有240个六邻体(hexon)、12个五邻体(penton)、12根纤毛(fiber)及一些小蛋白等。哺乳动物腺病毒的基因组DNA长约36kb,基因组的两端各有约100bp的反向末端重复序列(ITR),ITR与末端蛋白(TP)相结合,与基因组复制及早期基因的转录有关,ITR的内侧为病毒包装信号Ψ,参与腺病毒基因组的衣壳化。
基于人血清5型腺病毒的基因组结构,结合各基因的功能,科学家们开发了缺失E1和E3基因的Ad5腺病毒载体。E1基因在组装感染性病毒颗粒时必不可少,但是可以在HEK293包装细胞中得到补充,而E3基因不影病毒的包装。由于E1和E3基因的缺失,腺病毒载体可插入高达7.5kb的外源基因。
慢病毒属于逆转录病毒科,能够感染分裂和非分裂的细胞,从而将它们与普通的逆转录病毒区别开来。慢病毒基因组由两个拷贝的单链RNA组成,并被结构蛋白和酶蛋白包裹在衣壳中,这些结构蛋白和酶蛋白包括逆转录酶(负责将RNA转化为dsDNA)和DNA整合酶(负责将dsDNA整合到宿主基因组中)。
人类免疫缺陷病毒-1型(HIV-1)是较典型的慢病毒。其基因Gag、Pol和Env分别编码结构核心蛋白、逆转录酶和整合酶以及包膜糖蛋白;Tat和Rev参与病毒复制:Tat启动病毒基因组转录,并受长末端重复序列驱动,Rev促进病毒mRNA的核输出,并受到Rev响应元件的调控;包装信号(Ψ)是将病毒基因组进入衣壳的关键。此外,HIV-1基因组中包含的毒力因子Vif、Vpr、Vpu和Nef会干扰宿主防御机制,并包含在组装好的病毒粒子中。
HIV基因组
慢病毒是以HIV-1为基础发展起来的基因治疗载体。第一代慢病毒载体将所有包装元件编码在一个载体上,生物安全风险较高;第二代慢病毒载体去除了毒力因子并将包膜从包装载体中分离,提高了安全性并增强了病毒复制,而不干扰有功能的病毒粒子的生产。此外,3’LTR包含U3缺失,可以消除病毒基因组复制的启动子活性,并在不影响病毒粒子滴度或转基因表达的情况下自灭活载体。第三代慢病毒载体从包装载体中去除Rev,并用转移载体上游的一个组成启动子替换Tat,是目前受欢迎的慢病毒包装载体。
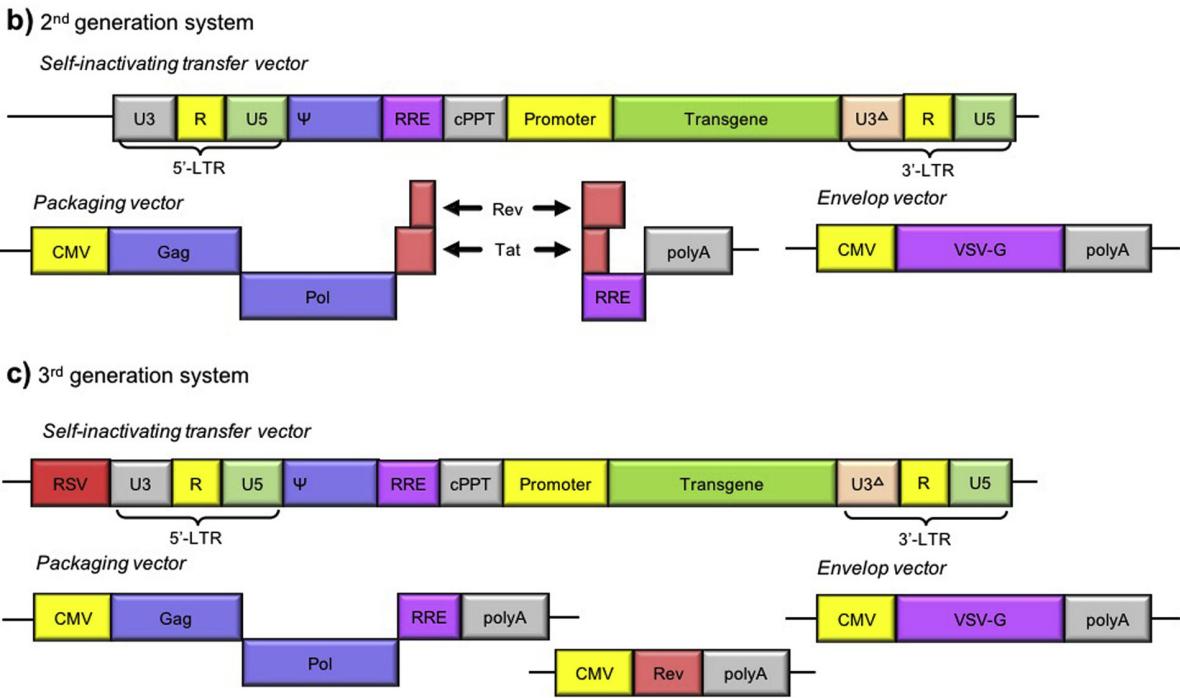
2代和3代慢病毒系统示意图
腺相关病毒(Adeno-associated virus,AAV)是一种单链DNA细小病毒,基因组大小为4.7 kb,由末端反向重复序列ITR和中间的rep、cap基因组成。ITRs对于病毒的复制和包装具有重要作用;rep基因编码参与病毒复制、包装和基因组整合的非结构蛋白,cap基因编码结构蛋白VP1、VP2和VP3,3种蛋白分别按1:1:10的比例组装形成病毒衣壳,充当病毒基因传递载体。此外,cap基因内嵌套的另一个开放阅读框编码装配激活蛋白AAP,参与衣壳蛋白的靶向和装配。
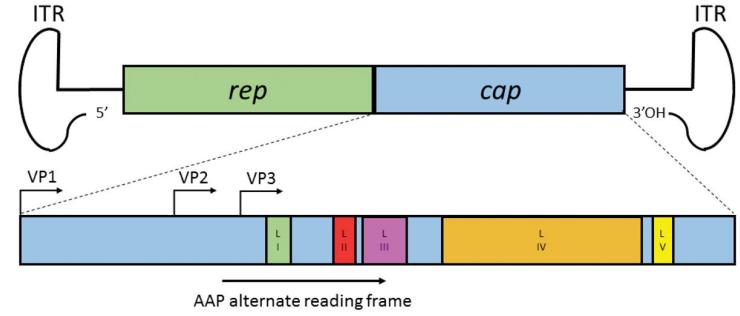
AAV的基因组结构
重组AAV载体可以通过将内源性的rep和cap基因替换为一个表达盒,该表达盒由一个启动子驱动一个感兴趣的转基因和一个poly(A)尾巴组成。通过包装质粒反式提供rep和cap基因以及腺病毒辅助质粒来包装载体。重组AAV基因传递效果好、缺乏致病性和安全性高、宿主细胞范围广、在体内表达时间长,是目前最有前途和最成功的基因治疗载体之一。
