01 研究背景
脂滴(LDs)是储存中性脂、胆固醇酯和甘油三酯的细胞器,从而保护细胞免受过量脂质的毒性,同时允许在营养剥夺时动员脂质。LD功能缺陷与许多疾病有关,zDHHC酰基转移酶介导的S酰化修饰修饰了数千种蛋白质,然而这种翻译后修饰对单个蛋白质的生理影响尚不清楚。2024年8月14日,浙江大学医学院附属第四医院Dante Neculai、刘伟团队联合加拿大多伦多大学Brian Raught团队和加拿大戴尔豪斯大学Gregory D. Fairn团队在Nature Metabolism (IF 18.9)上发表文章“S-acylation of ATGL is required for lipid droplet homoeostasis in hepatocytes”,发现zDHHC11通过改变脂肪三酰甘油脂肪酶(ATGL)来调节LD分解代谢,表明S酰化是ATGL功能和LD稳态调节的一种模式,调节这一途径可能为治疗与脂肪分解缺陷相关的疾病(如脂肪肝)提供治疗潜力。

02 结果展示
1. zDHHC11酰基转移酶影响LD的大小和丰度
为了深入研究蛋白S酰化在LD功能中的作用,作者在HepG2细胞分别过表达23种绿色荧光蛋白(GFP)标记zDHHC酶,并监测LD的大小和丰度,发现zDHHC11的过表达对LD的大小和丰度有最显著的影响,过表达zDHHC1的HepG2、Huh7和AML12细胞中的LD数量更少、单个LD的横截面积和每个细胞的总LD面积都显著减少。作者进一步确定了zDHHC11对LD的影响是否依赖其转移酶活性,在HepG2中的短暂过表达催化失活的zDHHC11 (C155S)突变体,发现不会改变HepG2中LD的大小和计数,表明zDHHC11介导的S酰化影响细胞的LD稳态。进一步研究发现ZDHHC11的损失增加了LD的大小、丰度和TAG的含量,zDHHC11是脂肪分解和β氧化所必需的。
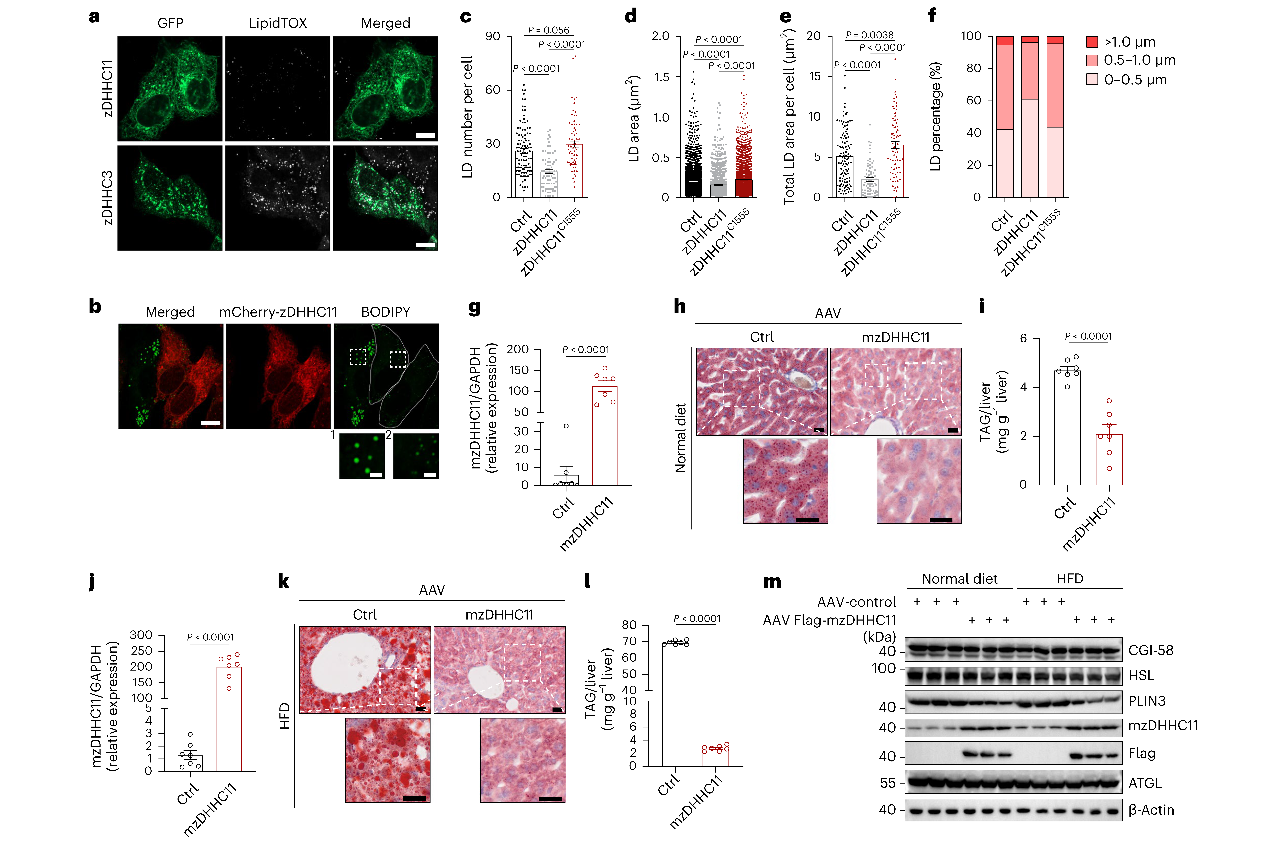
图1 zDHHC11酰基转移酶影响LD的大小和丰度
2. zDHHC11与ATGL相互作用并S酰化ATGL
先前的研究表明,与zDHHC11缺失类似,ATGL的缺失会导致LD显著增大,并显著减少脂肪酸向线粒体的转运。作者发现过表达 ATGL,导致LD显著减小,zDHHC11 敲除导致ATGL被激活,因此作者推测zDHHC11通过调节ATGL调控脂肪分解。作者首先探究了zDHHC11介导的LD表型是否与细胞中ATGL亚细胞定位有关,发现在每种代谢情景下,WT HepG2和HepG2 zDHHC11-KO细胞的ATGL亚细胞定位相似。然后作者推测zDHHC11可能通过蛋白相互作用直接影响ATGL,免疫沉淀实验表明zDHHC11通过与ATGL相互作用调节LD脂肪分解,酰基生物素交换(ABE)实验发现,细胞的内源性ATGL被S酰化,但在zDHHC11敲除的细胞中,ATGL的S酰化基本被消除。这些结果表明ATGL被S酰基化,zDHHC11是ATGL的主要酰基转移酶。
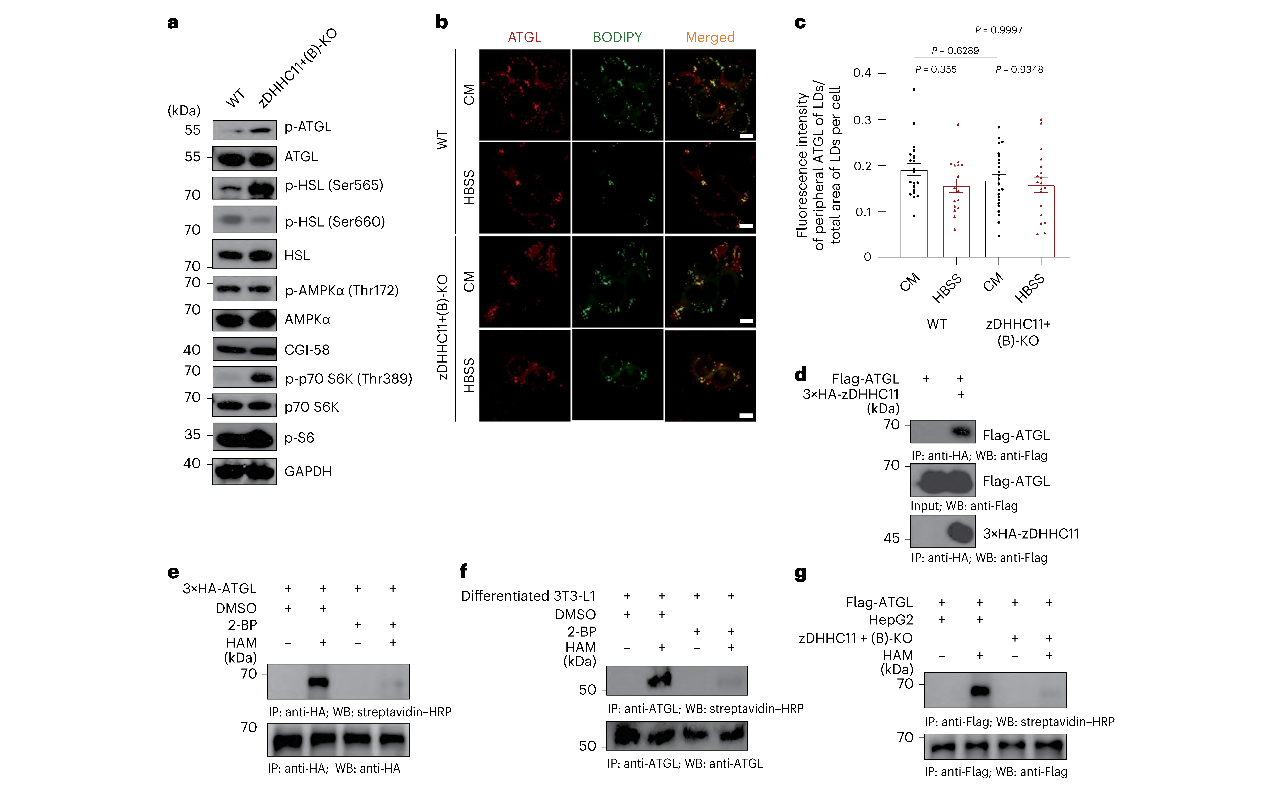
图2 zDHHC11与ATGL相互作用并S酰化ATGL
3. ATGL Cys15 S酰化是ATGL脂肪酶活性的必要条件
作者测定了ATGLS酰化位点,ABE分析确定Cys15为S酰化位点,并且C15S突变体保留了LD丰度并与LD相关。此外过表达ATGL可消除LD,过表达ATGL C15S突变基因和ATGLS47A(ATGL催化失活突变体)对LD的大小或丰度没有影响。为了进一步确认Cys15 S酰化位点的功能作用,作者进行了一系列检测,包括测量CM和血清饥饿条件下的线粒体OCR, Red C12脉冲追踪,以及营养饥饿下dgat1i依赖性LD形成,发现所有结果与HepG2 zDHHC11ko细胞的结果相似,进一步表明zDHHC11与ATGL之间的酶-底物关系以及翻译后修饰的重要性。作者在体内进一步证实了上述结果,利用AAV生成了肝脏内源性mATGL敲低并过表达WT mATGL或mATGLC15S的小鼠,发现与mATGLC15S组相比,mATGL组小鼠LD和TAG含量降低。此外与mATGL组相比,mATGLC15S组小鼠肝脏中PLIN3的表达显著增加,并且无论饮食变化如何,HSL、CGI-58和ATGL水平保持不变。这些发现强调了ATGL在Cys15位置的S酰化对其在细胞内的酶活性至关重要。
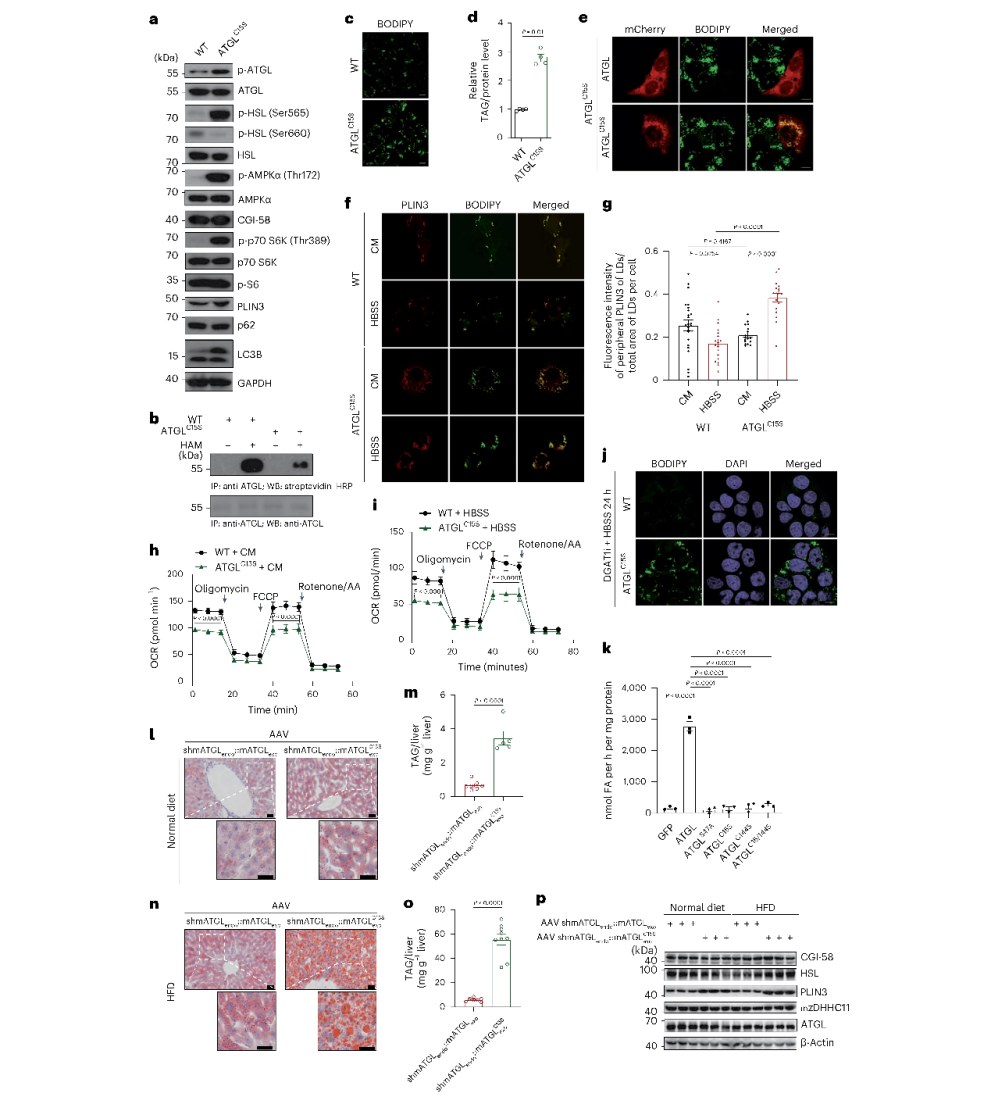
图3 ATGL Cys15 S酰化是ATGL脂肪酶活性的必要条件
03 实验结论
本研究发现zDHHC11在人类HCC样本中的表达降低,并揭示了一种以前未被认识到的调节ATGL活性和LD代谢的机制,这可能为靶向zDHHC11介导的ATGL S酰化修饰以纠正病理性脂质积累的策略铺平道路。
