肥胖是一个全球性的问题,需要确定更有效的治疗靶点,并更好地了解关键的分子发病机制。已知膜联蛋白A1(ANXA1)抑制磷脂酶A2,具有抗炎活性。然而,ANXA1在肥胖中的具体作用及其潜在的作用机制尚不清楚。2024年8月23日,北京大学郑乐民教授、华南理工大学刘东辉教授及西南医科大学徐勇教授共同通讯在Signal Transduction and Targeted Therapy (IF 40.8) 在线发表题为“Annexin A1 binds PDZ and LIM domain 7 to inhibit adipogenesis and prevent obesity”的研究论文,文章首次揭示了ANXA1抑制脂肪生成的分子机制,阐明了ANXA1是预防和治疗肥胖的潜在靶点。

01 研究结果
1、敲除ANXA1会加重HFD喂养小鼠的肥胖和代谢紊乱
基因表达检测发现在人类和小鼠中,脂肪组织ANXA1水平升高与肥胖之间存在相关性,与HFD-WT小鼠相比,Anxa1KO 小鼠经HFD 饲喂后体重显著增加、总体代谢率下降,表现出明显的葡萄糖耐受不良和严重的胰岛素抵抗,此外SAT脂质含量、肝脏重量和肝脏TG水平也明显高于HFD-WT小鼠,表明敲除ANXA1可促进HFD诱导的肥胖和代谢紊乱。为了确定脂肪组织特异性ANXA1的作用,研究团队构建了脂肪特异性ANXA1敲除 (Anxa1AKO)小鼠。与对照组小鼠相比,饲喂HFD 16周后Anxa1AKO小鼠表现为体重显著增加、整体代谢率下降、肥瘦质量比升高,SAT中分散的脂肪细胞增大;此外HFD-Anxa1AKO小鼠的TC、TG和LDL-C水平显著上调,表明维持循环脂质水平需要ANXA1;同时HFD-Anxa1AKO小鼠的基础胰岛素水平显著升高,与对照组相比,HFD-Anxa1AKO小鼠表现出葡萄糖耐受不良和胰岛素抵抗,这意味着ANXA1也是葡萄糖调节和影响外周组织胰岛素敏感性所必需的。进一步研究发现小鼠中ANXA1过表达可抵抗HFD诱导的肥胖,表明ANXA1对脂肪组织的稳态发挥有益作用,从而减轻脂肪毒性对其他器官的损害。
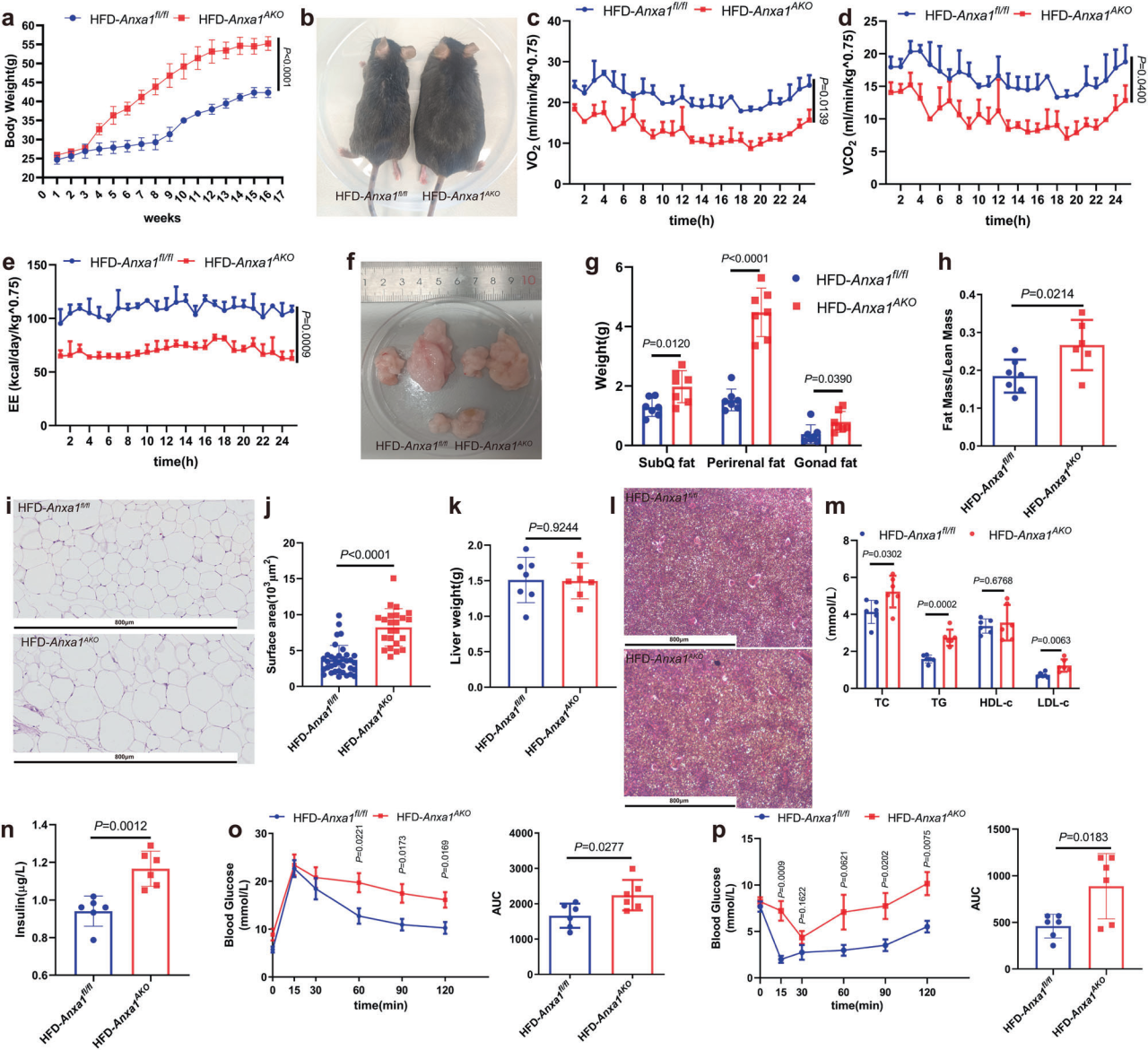
脂肪组织特异性缺乏ANXA1会加重HFD小鼠的肥胖和胰岛素抵抗
2、ANXA1抑制小鼠脂肪组织源性SVF向成熟脂肪细胞的分化
研究团队从脂肪组织中提取了含有大量前脂肪细胞的异质细胞群SVF,通过分析与脂肪生成密切相关基因的mRNA水平,发现在Anxa1AKO小鼠的SVF中,调节脂肪形成的关键基因Pparg mRNA水平显著升高;与对照组小鼠相比,来自Anxa1AKO小鼠的SVF表现出明显的脂肪细胞成熟倾向;另一方面,敲低WT小鼠SVF中的ANXA1表达可明显增加PPARγ蛋白水平。多项研究表明,SMAD家族蛋白可通过PPARγ诱导脂肪形成,数据显示SMAD4蛋白水平与ANXA1蛋白水平呈负相关,在SVF中使用siRNA或腺病毒沉默SMAD4可显著降低PPARγ的蛋白水平及脂肪生成相关基因的表达,并抑制SVF分化为成熟脂肪细胞,过表达SMAD4则显示相反的结果。利用ChIP-PCR/qPCR证实SMAD4是Pparg的一个转录因子,ANXA1通过降低SMAD4蛋白水平,从而下调PPARγ并抑制SVF向成熟脂肪细胞的分化。进一步的探索发现ANXA1通过与PDLIM7结合促进SMAD4 k48连接的特异性泛素化,导致SMAD4蛋白水平降低,最终抑制SVF分化为成熟脂肪细胞。
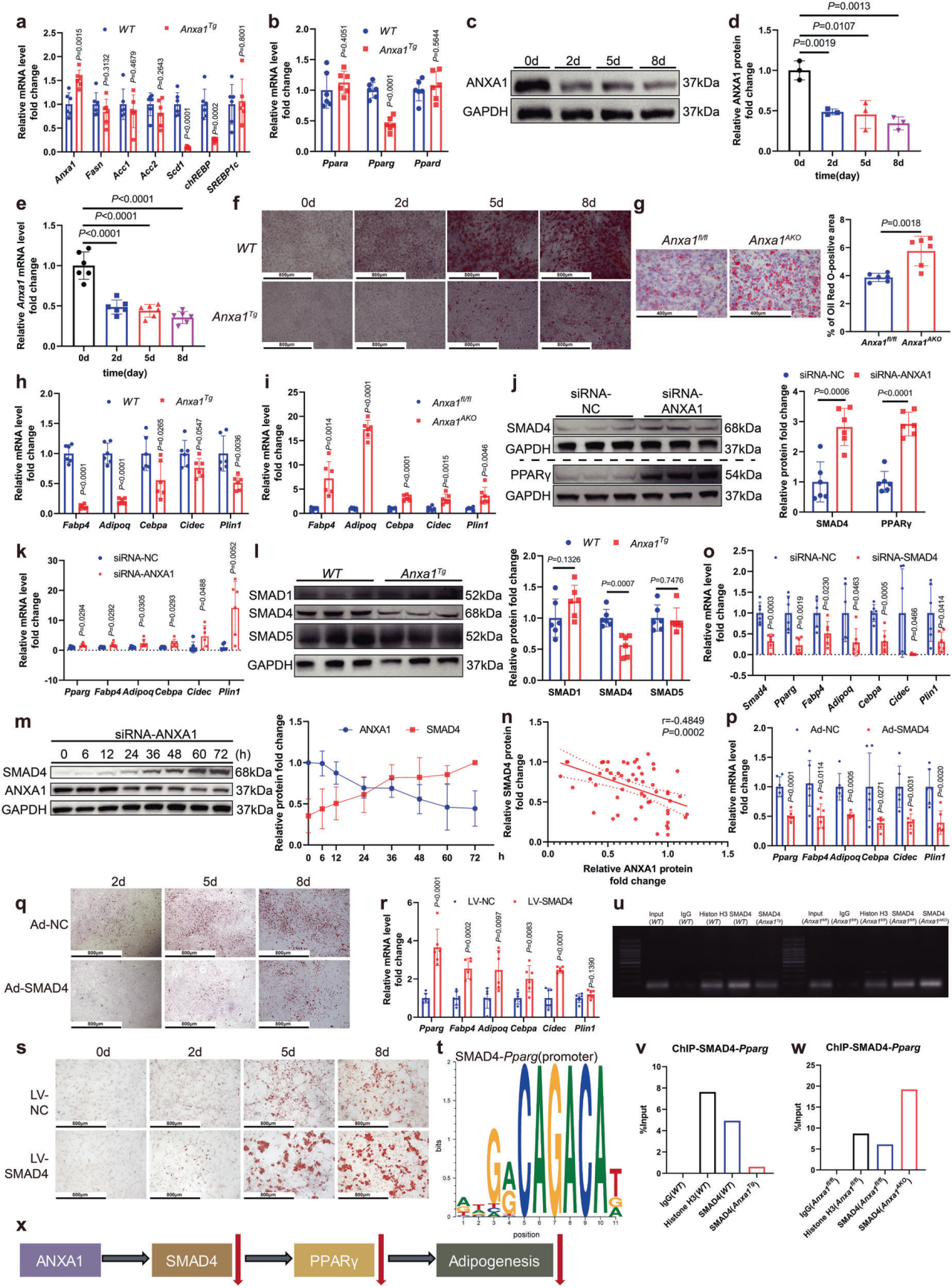
ANXA1缺乏诱导SMAD4和PPARγ蛋白水平升高,促进脂肪形成
3、在HFD小鼠中,Ac2-26与PDLIM7相互作用抑制脂肪生成并预防肥胖
为了进一步探讨ANXA1的活性N端肽Ac2-26是否通过抑制脂肪生成来预防肥胖,研究团队将Ac2-26与SVF孵育,结果显示Ac2-26治疗后SVFs中SMAD4蛋白水平以及脂肪形成关键基因mRNA水平显著降低,此外Ac2-26处理的SVF诱导分化潜能明显降低;进一步研究发现Ac2-26与PDLIM7存在相互作用,表明Ac2-26抑制脂肪形成的机制与ANXA1相似。随后研究人员将不同剂量的外源性Ac2-26每隔一天腹腔注射HFD喂养的db/db小鼠,持续10周,结果显示Ac2-26 (2 mg/kg)处理的db/db小鼠的血糖、TC和TG水平显著低于未处理的db/db小鼠,然而葡萄糖或胰岛素耐量没有明显变化,推测Ac2-26治疗预防db/db小鼠肥胖主要针对脂肪组织,可能与胰岛功能没有直接关系。
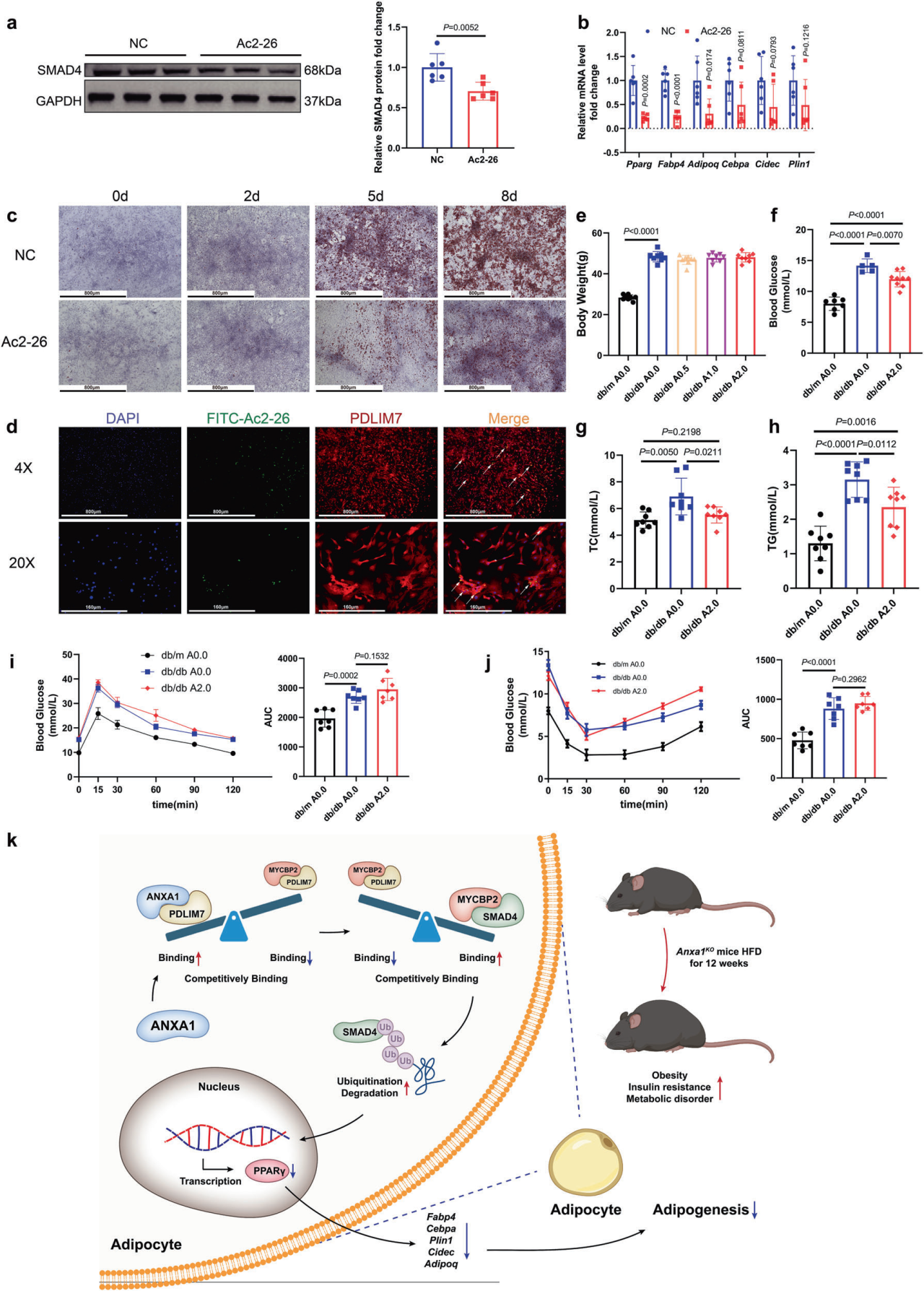
Ac2-26抑制HFD小鼠脂肪生成和预防肥胖
02实验结论
研究结果阐明了ANXA1可以预防肥胖并降低胰岛素抵抗。机制上,ANXA1抑制PDLIM7和MYCBP2之间的相互作用,促进MYCBP2介导的SMAD4泛素化和降解,从而抑制脂肪形成。本研究首次揭示了ANXA1与脂肪组织稳态和肥胖之间的分子机制,并为代谢紊乱的潜在干预提供了见解。
