结直肠癌(CRC)是世界第三大致死性肿瘤,其发生率不断攀升。耐药和肿瘤复发是结直肠癌治疗中的两个最具挑战性和未解决的问题,而癌症干细胞(CSCs)的鉴定和表征为克服这些挑战提供了新的思路。90%结肠癌的发生均源于Wnt/b-catenin信号传导通路,该通路在对CSCs的干性维持方面十分关键。

中国医学科学院药物研究所“天然药物活性物质与功能”国家重点实验室胡卓伟研究员团队在结肠癌发病的分子机制方面取得突破性进展。相关研究成果以“TRIB3 Interacts with Beta-catenin and TCF4 to Increase Stem Cell Features of Colorectal Cancer Stem Cells and Tumorigenesis”(TRIB3与Beta-catenin及TCF4相互作用增强结肠癌干细胞干性特征并促进结肠癌发生)为题,于2018年10月23日在国际权威期刊Gastroenterology上在线发表,影响因子20.773。论文链接:
https://doi.org/10.1053/j.gastro.2018.10.031
非常荣幸,文中使用了汉恒生物的慢病毒、腺相关病毒(AAV)等产品。
此研究提出TRIB3通过与b-catenin-TCF4形成异源三聚体以增强b-catenin-TCF4转录活性,进而支持CRC干细胞特征,促进CRC的发生、发展。此外,他们筛选到干扰TRIB3-b-catein的抗肿瘤肽,并证明了该多肽可对CRC产生明显的抑制作用。
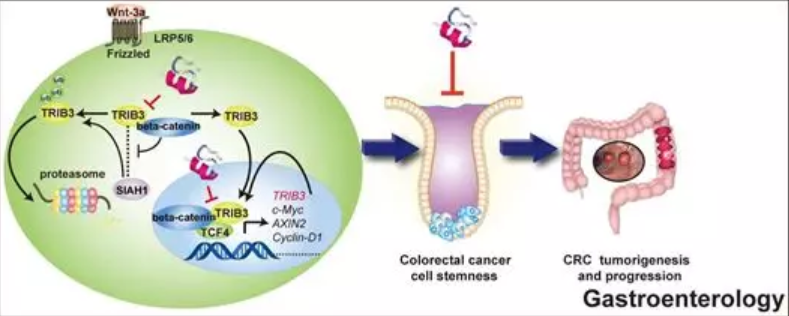
之前的临床研究表明,CRC组织中TRIB3表达高于正常组织,而此表达水平与CRC患者的存活率呈负相关。通过GSEA数据分析,该团队发现CRC中高表达的TRIB3与Wnt/b-catenin信号通路呈正相关关系。进而,研究人员通过在自发结肠癌的C57BL/6J-ApcMin/J小鼠中敲除Trib3来检查Trib3在肠道肿瘤发生中的作用,结果表明 Trib3敲除延迟了C57BL/6J-ApcMin/J小鼠的肿瘤发生时间。接下来,作者通过干细胞频率测算实验,证明TRIB3过表达使肿瘤干细胞频率增加了近4倍; 敲除b-catenin则反转TRIB3的这一作用。这些数据表明TRIB3通过b-catenin增强CRC特性。
进一步的实验中,该团队证明TRIB3,b-catenin之间及TRIB3,TCF4之间均存在相互作用。相互作用区域的免疫共沉淀结果显示TRIB3与b-catenin(ARM7-ARM9)区域存在互作,这与TCF4与b-catenin(ARM10)结合的关键氨基酸接近但不同。最终他们发现,TRIB3可募集TCF4至b-catenin,并通过稳定b-catenin-TCF4复合物增强其转录活性。有趣的是,该团队发现TRIB3与Wnt信号之间存在正反馈调节关系。通过将TRIB3启动子区与荧光素酶载体基因连接,作者发现过表达b-catenin可上调该段启动子的转录活性,通过CHIP实验他们进一步证实TRIB3是b-catenin的新靶基因。此外,他们还发现,b-catenin还可以通过干扰TRIB3与其E3泛素连接酶SIAH-1的结合而妨碍TRIB3的正常降解过程,从蛋白质稳定性角度上调TRIB3表达。
为了验证b-catenin -TRIB3相互作用在激活b-catenin传导以及CRC发病机制中的关键作用,该团队使用预测性I-TASSER服务器鉴定了6个来自TRIB3激酶样结构域的a-螺旋,通过BIACORE技术,他们证明T3A6与b-catenin存在较优的亲和力。通过将先前鉴定的细胞穿透肽与T3A6连接产生融合肽P2-T3A6。P2-T3A6不仅降低了CRC细胞中CSC标志物的表达,而且还抑制了HCT-8细胞的球形成能力; P2-T3A6还减少了源自CRC患者和C57BL/6J-ApcMin/J小鼠的肿瘤类器官的大小和生长。体内及体外研究表明P2-T3A6可破坏b-catenin-TRIB3及b-catenin-TCF4的相互作用并降低b-catenin靶基因的表达,这些数据表明P2-T3A6是一种有前景的先导化合物,通过破坏b-catenin -TRIB3相互作用来抑制b-catenin-TCF4转录活性并能够下调TRIB3表达,从而对CRC的发生进展及5-FU耐药产生较好的抑制作用。
综上所述,此研究阐述了TRIB3在结肠癌中的促肿瘤机制,并首次针对TRIB3-b-catenin这一新的靶点进行了抗肿瘤干扰肽的筛选及抑瘤效果的验证。这一研究为结肠癌的发病机制提供了新的理论基础,并为靶向Wnt/b-catenin信号通路开发抗肿瘤药物提供了新的思路。
