肝细胞癌(HCC)是一种恶性疾病。与酪氨酸激酶抑制剂(经典疗法)相比,免疫检查点抑制剂在治疗肝癌方面更有效,尽管其疗效有限。其中一个限制因素是肿瘤浸润淋巴细胞,特别是CD8+ T细胞的功能衰竭。本文的目的是确定导致CD8+T细胞在肝细胞癌中渗透的关键因素,并探讨其潜在的机制。

2023年1月,浙江大学医学院徐骁教授团队在国际肝脏病学权威杂志Hepatology上发表题为 SULT2B1-CS-DOCK2 Axis Regulates Effector T Cell Exhaustion in Hepatocellular Carcinoma Microenvironment 的研究论文。
通过机器学习和多重免疫组化分析,我们发现胞质分裂作用因子2 (DOCK2)是肝细胞癌中CD8+T细胞浸润的潜在指标。利用RNA测序、流式细胞仪分析和小鼠肝细胞癌模型,证明了DOCK2的失活导致了肿瘤中浸润CD8+ T细胞的功能衰竭。利用类靶向代谢组学、质谱和质谱流式,我们发现肿瘤细胞中SULT2B1合成的胆固醇硫酸盐抑制了T细胞中的DOCK2酶活性。通过虚拟筛选、分子对接模拟和实验验证,我们证明了妥拉磺脲(tolazamide)逆转DOCK2失活介导的CD8+T细胞功能耗竭,并增强了抗PD-L1抗体和阿帕替尼的联合治疗肝癌的效果。
研究表明,DOCK2控制CD8+ T细胞在肝癌中的浸润,而肿瘤细胞中合成的胆固醇硫酸盐促进了效应T细胞的功能衰竭。这些发现提示了肝癌免疫治疗中一个重要的调节因子和潜在的治疗靶点。
实验部分
为了研究DOCK2与TILs的关系,文章作者选择多重免疫荧光(mIHC)对TMA芯片进行染色后,借助Tissue
Cytometry技术,对每个TMA芯片点中,每个细胞的核面积、每个细胞面积、每个细胞的表达强度以及细胞在不同微环境中密度分布进行了精准定量分析后。通过单个细胞上不同蛋白标记物的表达情况,选择了ARHGAP25+CD3+CD8+ T细胞, DOCK2+CD3+CD8+ T细胞, IL16+CD3+CD8+ T细胞, INPP5D+CD3+CD8+ T细胞, LCP2+CD3+CD8+ T细胞等不同亚群细胞,根据细胞分布情况发现DOCK2失活可以诱导TILs的耗竭,并且这种效应是不可逆的。
与其他定量技术不同,Tissue Cytometry技术是可以在组织切片中针对每个细胞的细胞质设置独立的扩张性识别算法,力求获得细胞质蛋白标记染色的全部结构面积,再通过计算面积内所有像素点的染色强度以此获得单细胞蛋白的定量结果。
除此之外,Tissue Cytometry技术中切片全景成像部分,通过顶级的成像硬件,最大程度还原了免疫荧光染色的真实情况。在文章中,作者还对DOCK2与转铁蛋白受体(TFRC)的相互作用进行研究,通过免疫荧光染色的共定位研究发现,DOCK2与TFRC病存在明确的相关性,为进一步对其铁死亡信号通路等研究打下了基础。

Figure 1 SULT2B1产生的CS减少肝细胞癌中T细胞的浸润
(F)人肝癌组织中SULT2B1(绿色)和CD8(红色)的多色免疫荧光图像。
(J)分离肝癌组织CD3+T细胞(绿色)和CD8+T细胞(红色)多色免疫荧光图像。
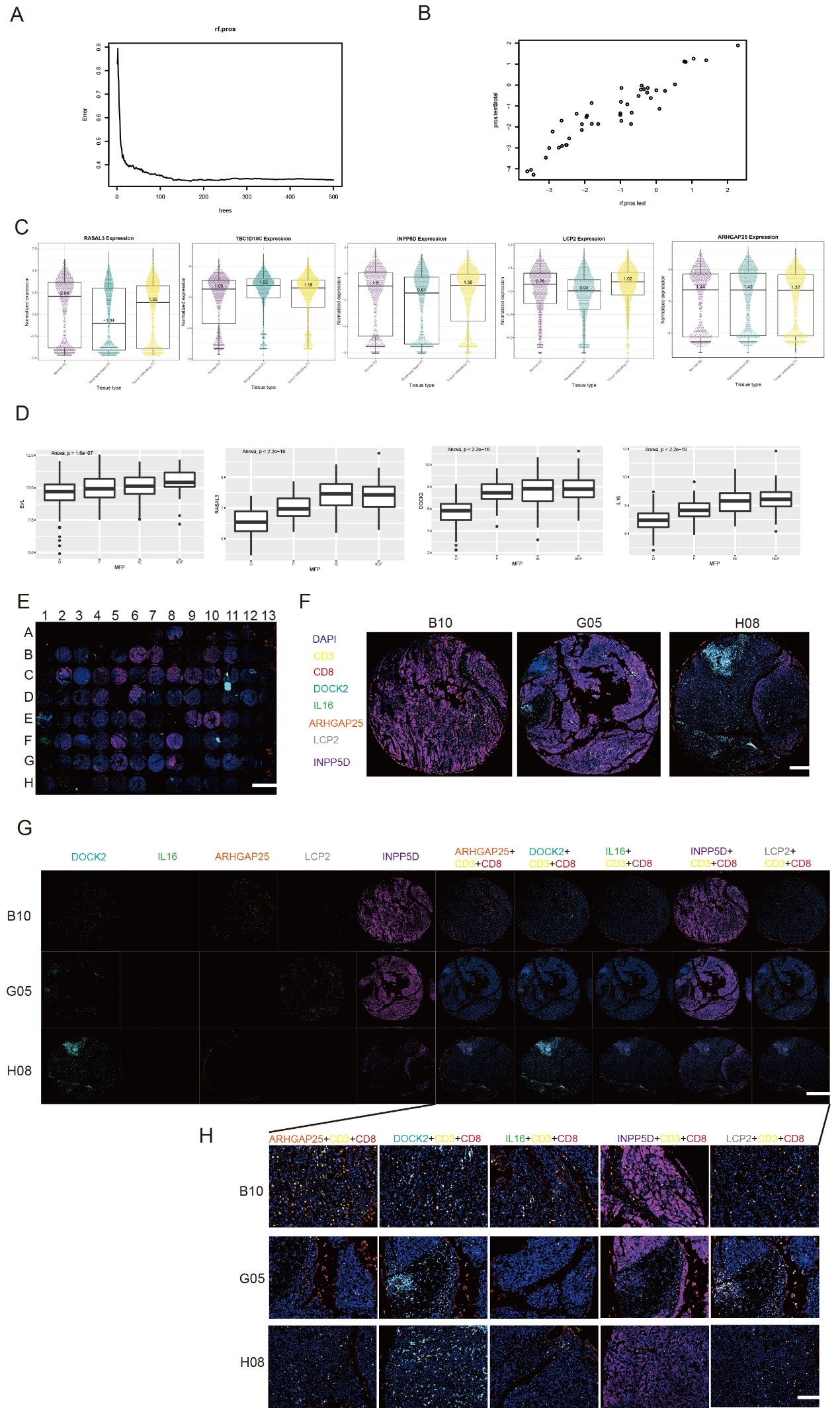
Figure 2 DOCK2与HCC中CD8+T细胞浸润密切相关。
(E) HCC TMA样本中多重免疫荧光染色全景图像。
(F)HCC组织微阵列中三个示例组织点的概述。
(G-H)HCC TMA中ARHGAP25+CD3+CD8+T细胞、DOCK2+CD3+CCD8+T细胞,IL16+CD3+C8+T细胞,INPP5D+CD3+CT8+T细胞和LCP2+CD3+CD8+TT细胞的多重免疫荧光染色。

Figure 3 使用HCC TMA分析CD8+T细胞中ARHGAP25+CD8+、IL-16+CD8+、LCP2+CD8+、INPP5D+CD8+或DOCK2+CD8+的定量分析结果。
