脑肿瘤是最具破坏性的癌症形式之一,而胶质母细胞瘤 (GBM) 是该疾病最具侵袭性和致命性的形式。GBM特点是预后差、死亡率和复发率高。 尽管在手术、放疗和化疗方面取得了进步,但 GBM 的中位生存时间仅为 15-16 个月,5 年总生存率不到 5%。 因此,迫切需要开发新的有效治疗策略来治疗 GBM。近期,多篇文献报道GBM研究新进展,可能为改善GBM临床结局提供帮助。
1. M1-巨噬细胞胞外囊泡在GBM中的协同治疗作用
中国科学院过程工程研究所生化工程国家重点实验室 Wei Wei团队报告M1 样巨噬细胞衍生的细胞外囊泡 (M1EV)作为 GBM 治疗药物输送系统的潜在价值[1]。研究团队将 M1 样巨噬细胞与化疗药物巴诺蒽醌 (AQ4N, A) 一起孵育,然后释放和分离内核中携带 AQ4N 的 M1EV(A-M1EV)。随后,这些载药 EV 在其膜中用疏水性双草酸酯(CPPO,C)和二氢卟吩 e6(Ce6,C)进行加工(CCA-M1EV)。在 GBM 肿瘤中积累后,CCA-M1EV 诱导 M2 到 M1 极化以进行肿瘤微环境免疫调节,导致 H2O2 水平升高。此外,H2O2与CPPO反应产生化学能,该能量可用于Ce6活化,产生大量活性氧,实现化学激发光动力疗法(CDT)。由于该反应消耗氧气,肿瘤缺氧的恶化也导致无毒的 AQ4N 转化为有毒的 AQ4 用于化疗。因此,CCA-M1EV 在 GBM 中实现了协同免疫调节、CDT 和缺氧激活化疗(图1),从而发挥有效的治疗作用。CCA-M1EV 在细胞来源的异种移植物和患者来源的异种移植物模型中对 GBM 具有明显疗效,强调了M1EV 系统在支持难以治疗GBM中的强大潜力。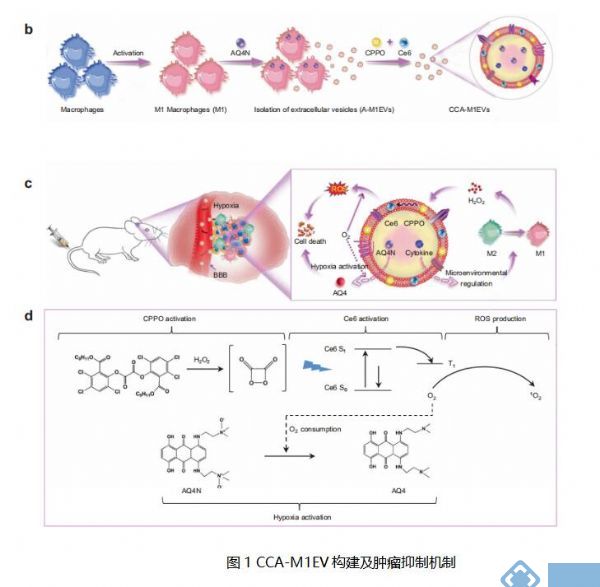
2. 脑膜炎奈瑟菌 Opca 蛋白/MnO2 混合纳米颗粒克服血脑屏障治疗GBM
GBM治疗的主要障碍是药物通过血脑屏障(BBB)的有效性低。脑膜炎奈瑟菌通过一种名为 Opca 的外膜侵袭蛋白的引导,在中枢神经系统中特异性富集。武汉大学生物医学高分子重点实验室Xian-Zheng Zhang团队通过将化疗药物甲氨蝶呤(MTX)装入表面修饰脑膜炎奈瑟菌Opca蛋白的中空二氧化锰(MnO2)纳米颗粒中,证明仿生纳米治疗系统 (MTX@MnO2-Opca) 可以有效地克服 BBB[2]。Opca 蛋白的存在使药物能够穿过 BBB 并渗透到肿瘤组织中。该纳米治疗系统在GBM内蓄积后,催化肿瘤组织中多余的H2O2分解,从而产生O2,缓解肿瘤缺氧,增强GBM对化疗的敏感性(图2)。这种仿生纳米治疗系统可能在GBM的治疗中表现出巨大的潜力。
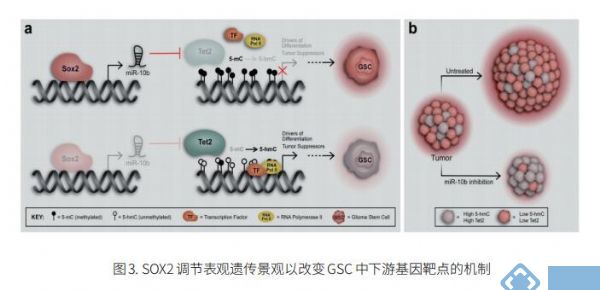
3. SOX2通过抑制TET2,解除5hmC和5mC DNA修饰,诱导GBM细胞干性和肿瘤增殖
DNA甲基化是一个可逆的过程,由10 - 11易位(TET)家族的酶(TET1, TET2, TET3)催化,将5-甲基胞嘧啶(5mC)转化为5-羟甲基胞嘧啶(5hmC)。在人类癌症中广泛报道了 5hmC 和 5mC 模式的改变,并且 5hmC 的缺失与预后不良相关。美国约翰霍普金斯大学医学院神经内科John Laterra团队表明,TET2 缺失与GBM干细胞(GSC)相关,并与 GBM 患者的不良生存率相关[3]。他们进一步确定了抑制 TET2 表达、抑制 5hmC、增加 5mC 水平并诱导 GBM 细胞干性和肿瘤增殖潜力的 SOX2:miR-10b-5p:TET2 轴(图3)。体内递送使 TET2 表达和 5hmC 水平正常化的 miR-10b-5p 抑制剂可抑制肿瘤生长并延长携带预先建立的原位 GBM 异种移植物的动物的存活时间。这些发现强调了 TET2 和 5hmC 损失在 SOX2 驱动的肿瘤发生中的重要性及其治疗靶向的潜力。
4. 转录延伸机制增强GBM干细胞的免疫治疗
GBM以GSC促进的治疗耐药性为特征。美国UPMC希尔曼癌症中心Jeremy N. Rich团队对患者来源的GSC、分化的胶质母细胞瘤细胞(DGC)和神经干细胞(NSC)进行基因表达和全基因组CRISPR/Cas9筛选,以确定GSC干细胞的主要调控因子[4]。他们发现YY1 和转录 CDK9 复合物对于 GSC 在体外和体内的存活和维持至关重要。YY1 与 CDK9 相互作用以调节 GSC 中的转录延伸。 YY1-CDK9 复合物的遗传或药理学靶向引发 RNA m6A 修饰依赖性干扰素反应,减少调节性 T 细胞浸润,并增强免疫检查点治疗在GBM中的功效(图4)。这些结果提示靶向YY1-CDK9 转录延伸复合物的药物可抑制 GSC自我更新和增殖,并且可以与免疫疗法相结合以协同治疗 GBM 患者。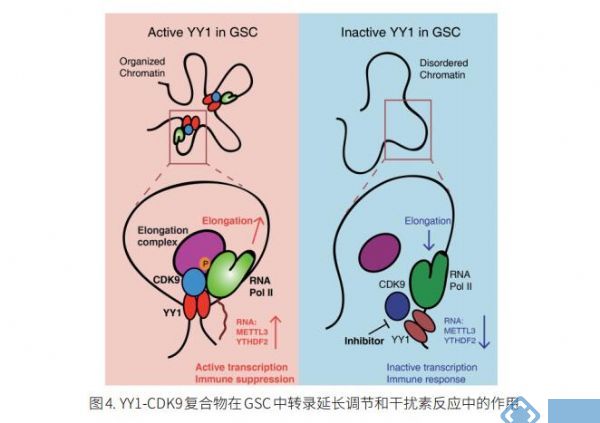
参考文献
[1]Wang X, Ding H, Li Z, et al. Exploration and functionalization of M1-macrophage extracellular vesicles for effective accumulation in glioblastoma and strong synergistic therapeutic effects[J]. Signal Transduct Target Ther. 2022;7(1):74.(IF=18.187)
[2]Dong CY, Huang QX, Cheng H, et al. Neisseria meningitidis Opca Protein/MnO2 Hybrid Nanoparticles for Overcoming the Blood-Brain Barrier to Treat Glioblastoma[J]. Adv Mater. 2022;34(12):e2109213.(IF=30.849)
[3]Lopez-Bertoni H, Johnson A, Rui Y, et al. Sox2 induces glioblastoma cell stemness and tumor propagation by repressing TET2 and deregulating 5hmC and 5mC DNA modifications[J]. Signal Transduct Target Ther. 2022;7(1):37.(IF=18.187)
[4]Qiu Z, Zhao L, Shen JZ, et al. Transcription Elongation Machinery Is a Druggable Dependency and Potentiates Immunotherapy in Glioblastoma Stem Cells[J]. Cancer Discov. 2022;12(2):502-521. (IF=39.397)
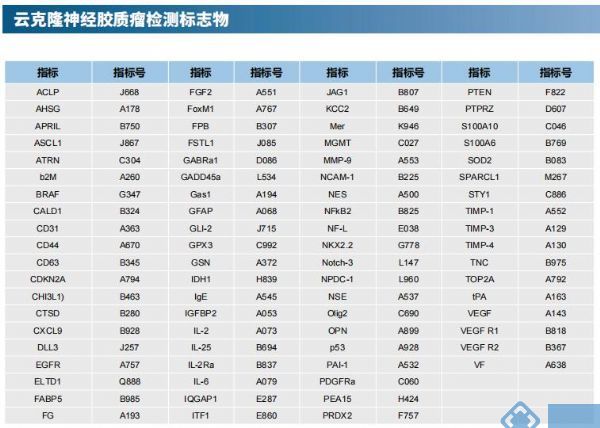
云克隆不仅可提供多种肿瘤实验动物模型,包括肿瘤移植动物模型、自发性肿瘤动物模型、诱发性肿瘤动物模型、肿瘤转移动物模型等,涵盖常见肿瘤研究。还具有各类癌症检测指标及上述SOX2、YY1、CDK9相关产品,可助力广大科研工作者进行肿瘤相关研究。