慢病毒的感染具有整合特性,能够将外源基因有效地整合到宿主染色体上,达到持久性表达,因而非常适合构建稳转细胞株,用于基因的功能研究,然而包装容量小、病毒滴度低也是限制它大显身手的弊端所在,因此只适合常规基因,无法实现较大基因的稳转株构建。AAV虽然是体内研究的理想载体,但由于载体容量等原因也无法实现较大基因在体内的长期稳定表达。因此,开发一种新的基因传递工具对于较大基因的体内外研究至关重要。
腺病毒包装容量大,几乎能感染所有类型的细胞,容易制得高滴度的病毒,而且非常适合体内外研究,因此利用腺病毒来制备稳转株,实现基因在体内的长期稳定表达,可能是开发这一新型工具的重要突破口。然而,腺病毒感染细胞只能实现基因的瞬时表达,单从这一点考虑,恐难实现。如何才能发挥其长处,弥补其短板,是需要攻克的难点。
Gene delivery
我们知道,PiggyBac(PB)转座子是研究基因功能,制备转基因动物及基因治疗的优良载体,具有广泛宿主谱,通过“剪切-粘贴”机制介导外源基因的稳定整合与表达。但其目前应用的主要方式仍是通过质粒转染,而质粒载体本身存在转导效率低、非整合等弊端。综合piggybac系统实现大基因稳转和腺病毒广泛的感染特性两个方面的优点,我们开发了一种新的可以实现用于大基因稳转及长时程表达的腺病毒-piggybac新系统。

腺病毒与PiggyBac(PB)强强联合
强强联合
腺病毒与转座子联手
助力体内外研究
在实际应用过程中,转座酶和转座子分别被构建在两个载体上,而后导入细胞。我们发现,无论是质粒组还是腺病毒组,添加转座酶组细胞存活数量要远远多于未添加组,这说明了转座酶在转座过程中的必需性;而腺病毒组细胞存活数量远多于质粒组,这说明腺病毒转座体系的效率更强。(图A、B为质粒转座体系,图C、D为腺病毒转座体系)
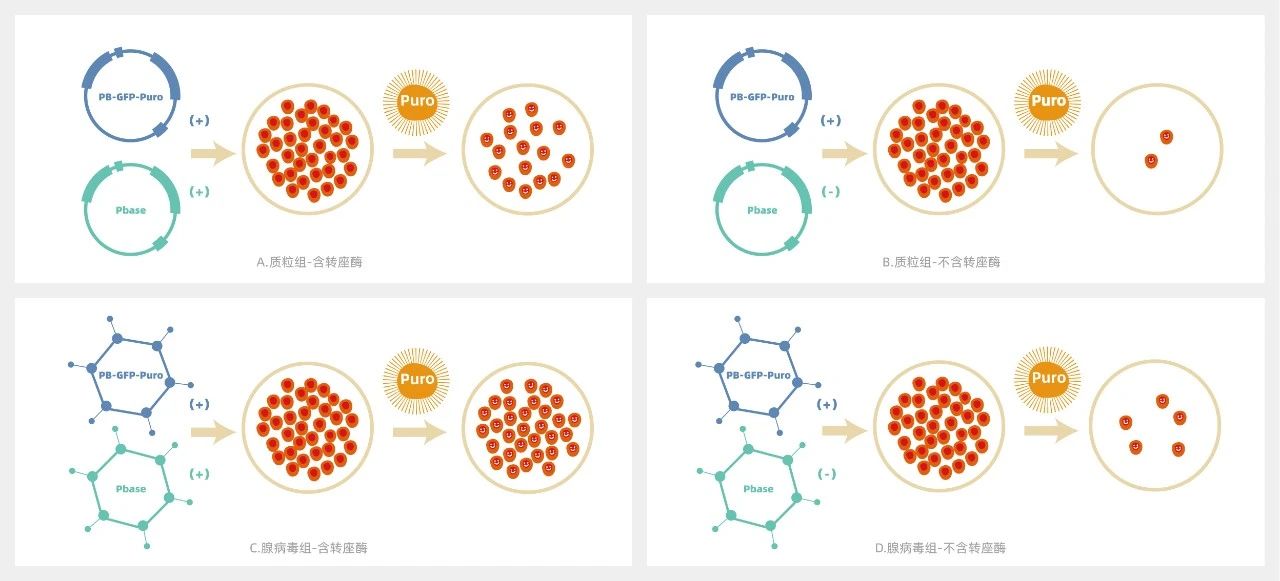
质粒转座子体系 pk 腺病毒转座子体系
一、腺病毒转座体系较质粒转座体系效率更高
首先,我们将PB转座子和转座酶分别构建至腺病毒载体并包装腺病毒,分别通过质粒和病毒感染两种方式处理A549细胞。发现,质粒转染48小时,Puro加压7天后,加转座酶组细胞大量存活,而对照组细胞几乎全部凋亡。腺病毒感染48小时,Puro加压两周后,加转座酶组细胞稳转扩增,对照组细胞逐渐凋亡(如下图所示)。这说明,转座酶在转座子转座过程是必需的,且腺病毒转座子比质粒转座子转座效率更高。
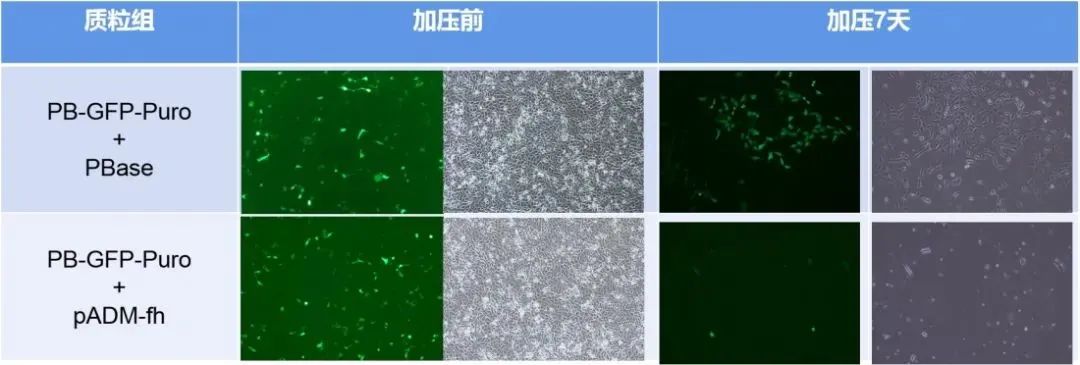
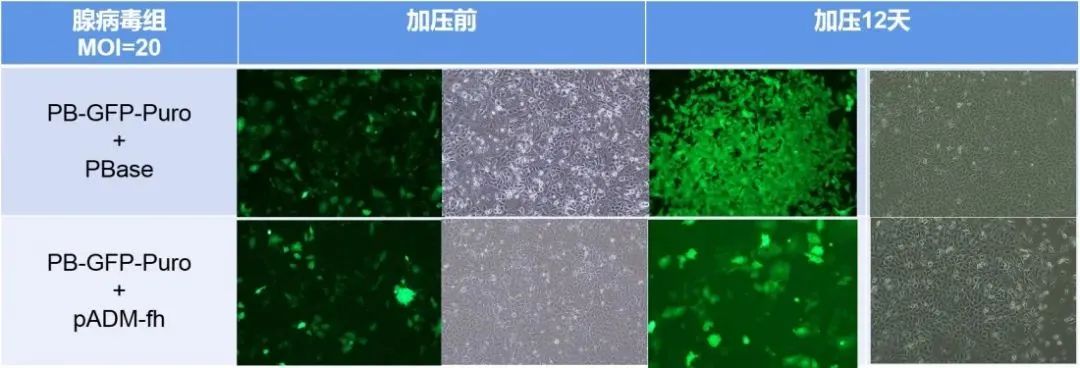
质粒组与病毒组实验结果
二、腺病毒-PB转座体系效率分析
为评估腺病毒-PB转座体系的转座效率,我们对腺病毒组存活细胞数量进行了分析。计数与染色结果显示,加转座酶组的存活细胞数量是未加转座酶组的近33倍(如下图所示)。

腺病毒组存活细胞分析
三、腺病毒-PB转座体系应用
腺病毒与PiggyBac转座系统的融合,既可进行细胞的高效感染,又可实现外源基因在宿主细胞的稳定整合与表达。因此,如果您有基因的稳转需求,无论是常规基因还是较大基因,常规细胞还是难感染的细胞,体内研究还是体外研究,都可以优先选择腺病毒-PB转座体系。利用这一体系可以完美地解决稳转株构建以及外源基因在动植物体、组织中稳定表达的难题,尤其是对那些较大基因来说,这一体系尤其适用,欢迎各位老师咨询订购!
咨询订购
① 拨打热线电话400-077-2566
或 致电您的区域经理;
② 添加下方维真客服13012994257微信咨询订购!

