CRISPR/Cas9,基因编辑技术的新进展

祝贺MIT张锋研究组所取得的重要发现,并感谢他们选用来自Sellckchem的高质量产品。
自2013年以来,CRISPR/Cas9成为目前最热的基因编辑系统。MIT的科学家对CRISPR/Cas9进行了改造。现在,科学家可以用这一技术在细胞中有效启动任何基因,更简便地研究不同基因的功能。这一成果发表在2014年12月10日的Nature杂志上。领导这项研究的张锋(麻省理工学院脑与认知科学助理教授、McGovern 脑研究所和Broad研究所核心成员,Feng Zhang,音译张锋)说,改造后的CRISPR技术,可以快速对整个基因组进行功能筛选,帮助人们鉴定涉及特定疾病的基因。张锋等人在该研究中就鉴定了让黑色素瘤细胞抵抗癌症药物的几个基因。

基因编辑技术,是指对DNA核苷酸序列进行删除和插入等操作。基因编辑技术使得人们可以依靠自己的意愿改写遗传密码。 长期以来,对DNA的编辑只能通过物理和化学诱变、同源重组等方式来实现。这些方法要么编辑位置随机,要么需要花费大量人力物力进行操作。因此,能够方便而精确的对DNA和核苷酸序列进行编辑,是科研工作者们长期以来的梦想。CRISPR-Cas9系统的诞生和成熟标志这这一梦想逐渐变为现实。在诸如医疗、农业、畜牧业等研究中,这一技术显现除了巨大的应用前景,具有里程碑意义。CRISPR-Cas9被评为2013年生物学10大突破之一。
作为被称作第三代基因编辑技术的CRISPR-Cas9系统,相比于ZFN系统和TALEN系统,它有着许多无可比拟的优点。首先,CRISPR-Cas9系统的可用位置更多。理论上基因组中每8个碱基就能找到一个可以用CRISPR-Cas9进行编辑的位置,可以说这一技术能对任一基因进行操作,而TALEN和ZFN系统则在数百甚至上千个碱基中才能找到一个可用位点,大大限制了使用范围。其次,CRISPR-Cas9系统更具有可拓展性,例如可以通过对Cas9蛋白的修饰,让它不切断DNA双链,而只是切开单链,这样可以大大降低切开双链后带来的非同源末端连接造成的染色体变异风险。此外还可以将Cas9蛋白连接其他功能蛋白,来在特定DNA序列上研究这些蛋白对细胞的影响。第三, CRISPR-Cas9系统的使用极为方便,只需要简单的几步就能完成,几乎任何实验室都可以开展工作。
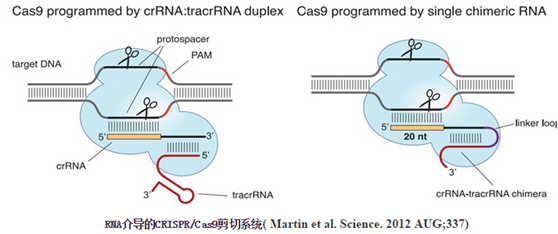
CRISPR(成簇的规律间隔短回文重复序列,clustered regularly interspaced short palindromic repeats)本身是一种防御系统,用以保护细菌和古细菌细胞不受病毒的侵害。在这些生物基因组中的CRISPR位点能表达与入侵病毒基因组序列相匹配的小分子RNA 。当微生物感染了这些病毒中的一种,CRISPR RNA就能通过互补序列结合病毒基因组,并表达CRISPR相关酶,也就是Cas,这些酶都是核酸酶,能切割病毒DNA ,阻止病毒完成其功能。将CRISPR/ Cas系统用于其它非细菌细胞需要满足两个条件:一个Cas酶,用于切断靶标DNA,比如目的基因中的DNA片段,另外一个就是称为导向RNA(gRNA)的RNA分子,这种分子能通过互补结合靶标。
近两年来,Cas9工具被广泛用于关闭或替换基因,而张锋等人这次成功将它改造来启动基因。之前也有人尝试过用CRISPR系统启动基因。他们失活了Cas9的剪切活性,并将Cas9连上活化结构域,这些结构域能够招募转录机器,启动转录过程。然而这些努力并不能持续启动基因转录。张锋研究团队之前曾经获得了Cas9结合引导RNA和目标DNA的结构,他们决定在此基础上对CRISPR-Cas9进行改造。科学家过去是将活化结构域连接在Cas9的末端,但效果并不理想。张锋团队意识到,RNA从Cas9复合体伸出的两个小环是更好的连接位点,这样活化结构域在招募转录机器时就更加灵活。他们用改造后的CRISPR系统成功激活了十个基因。这些基因的转录都得到了两倍以上的增涨,许多基因的活性甚至有了几个数量级的增加。随后,研究人员建立了70, 290个引导RNA的文库,来靶标人类基因组超过两万个基因。他们由此鉴定了让黑色素瘤抵抗药物PLX-4720的基因。PLX-4720对于携带BRAF突变的患者疗效比较好,残存下来的癌细胞会长成新的肿瘤,导致癌症复发。
研究人员将CRISPR元件引入大量体外培养的黑色素瘤细胞,不同细胞对应靶标不同基因的引导RNA。 然后他们用PLX-4720处理这些细胞,由此鉴定帮助癌细胞生存的基因。他们几个新的抗性基因。这样的研究可以帮助人们开发新的癌症药物。下一步张锋实验室计划继续进行筛选,张锋最感兴趣的是利用CRISPR来修复人类组织中的基因,治疗诸如亨廷顿氏病和精神分裂症等神经精神疾病。为了探求这一技术的治疗应用,他和其他CRISPR先锋创立了一家总部设在剑桥的Editas Medicine公司,得到了风险投资基金4300万美元的支持。张锋说:“CRISPR使得我们能够开始对基因组进行校正。由于易于编程,它将为解决影 响少数人但却极具破坏性的突变开启大门。” CRISPR/Cas9技术之后的发展如何,让我们拭目以待!
Reference:
Silvana Konermann, Mark D. Brigham, Alexandro E. Trevino, Julia Joung, Omar O. Abudayyeh, Clea Barcena, Patrick D. Hsu, Naomi Habib, Jonathan S. Gootenberg, Hiroshi Nishimasu, Osamu Nureki& Feng Zhang. Genome-scale transcriptional activation by an engineered CRISPR-Cas9 complex. Nature, 10 December 2014; doi:10.1038/nature14136
