由于缺乏有效的基因递送工具,基因转染在神经科学领域受到了限制。最近,脂质纳米粒 (LNP) 作为在体内外均安全有效的核酸输送载体而引起了人们的兴趣。然而,脂质纳米粒的传统制备方法面临着许多挑战,例如操作人员差异,以及放大困难。在此,我们介绍了一种基于微流控的可放大 NanoAssemblr 平台,可重复、稳健地制备质粒-脂质纳米粒。质粒-脂质纳米粒实现了95%的转染效率,并在体内外实现了外源基因在难以转染的神经元中的高度表达。
通过脂质纳米颗粒进行基因输送
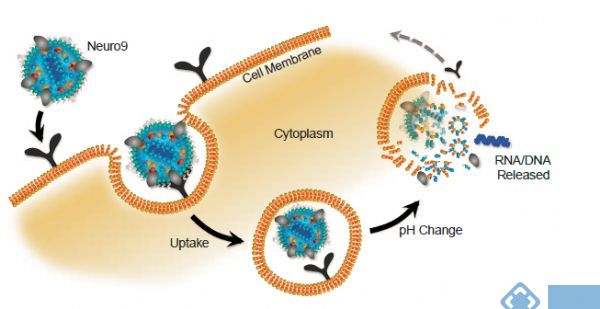
脂质纳米粒(LNP) 是一种可用于将核酸递送至细胞的平台。脂质纳米粒模拟通过内源性途径吸收的低密度脂蛋白(LDL)。脂质纳米颗粒对pH 值敏感,旨在将其荷载的药物释放到细胞质中。
NanoAssemblr 系统
NanoAssemblr 平台采用微流控技术精确控制微升至毫升级规模的纳米颗粒制备。

大鼠原代神经元中的体外GFP 表达

共聚焦荧光显微结果显示在5 μg/mL ApoE 的情况下,用包封GFP 编码的质粒DNA 的脂质纳米粒处理后,MAP2 阳性神经元中的GFP 表达(绿色)。
大鼠大脑中的体内GFP 表达

显示对10月龄FVB小鼠纹状体注射含GFP编码质粒DNA的脂质纳米粒后48小时GFP表达(绿色)的脑切片荧光显微照片。注射5 μl 3 mg/mL GFP质粒-脂质纳米粒制剂。用DAPI(蓝色)染色的细胞核、DiD(红色)染色的脂质纳米粒以及GFP表达(绿色)共定位于同一张图片内。脂质纳米粒摄取和GFP表达两者共定位于注射部位即纹状体中,并已扩散到周围其他区域,包括脑室系统和胼胝体在内的多个部位。
流式细胞分析显示 GFP 表达和颗粒摄取

GFP+神经元的百分比表明质粒表达取决于剂量,剂量为0.6 ug/mL时百分比最高。

对 GFP MFI 也观察到了同样的剂量反应模式,每次处理 n=3,采用Dunnett多重比较检验进行单因素方差分析,**** p<0.0001, ** p<0.005。
用包封GFP 编码质粒DNA 的脂质纳米粒处理过的DIV 7大鼠原代神经元中GFP表达的流式细胞分析。在最高剂量(0.6 ug/mL) 下,超过60% 的神经元表达了GFP。GFP阳性百分比和GFP表达强度(平均荧光强度;MFI)均可通过GFP质粒-脂质纳米粒的剂量进行滴定测量。在有1 μg/mL ApoE的情况下处理48 小时后,进行流式细胞分析。

DiD+神经元的百分比表明脂质纳米粒摄取取决于剂量,剂量为0.6 ug/mL时百分比最高。

对 DiD MFI 也观察到了这样的剂量反应模式,每次处理n=3,采用Dunnett多重比较检验进行单因素方差分析,**** p<0.0001,** p<0.005。
对大鼠原代神经元中质粒-脂质纳米粒摄取的流式细胞分析。在DIV 7用含有质粒DNA的脂质纳米粒和荧光染料DiD对细胞进行处理。质粒剂量为0.6 μg/mL时,超过95%的神经元表现出脂质纳米粒摄取;在该剂量的十分之一(0.06 μg/mL) 下,摄取率超过85%。在有1 μg/mL ApoE的情况下处理48 小时后,进行流式细胞分析。
附加表征
未观察到脂质纳米颗粒存在细胞毒性

Spark和Benchtop的包封率接近 100%

脂质纳米颗粒粒径大小不受质粒长度影响

由于样品切换的缘故,在Benchtop上制备的质粒脂质纳米颗粒粒径较小。

基于微流控的NanoAssemblr?技术能够以可重复的方式制备质粒-脂质纳米粒,这些颗粒可在体内外有效介导原代神经元中的基因表达,表明在NanoAssemblr?平台上制备的质粒-脂质纳米粒是神经科学应用领域的有效输送工具。
在NanoAssemblr 平台上制备质粒-脂质纳米颗粒

关于锘海
锘海生命科学是一家创新型的科技公司,拥有自主研发及独立生产能力。锘海生命科学致力于生命科学领域,为高校、科研院所、医院及企业提供实验仪器、试剂耗材、CRO/CMO技术服务等一站式整体解决方案,满足产业中的研发和生产需求。
地址:上海市松江区莘砖公路650号B座1203室
电话:86-21-37827858
邮件:info@nuohailifescience.com
网址:www.nuohailifescience.com