CRISPR/Cas系统是细菌和古细菌在不断进化的过程中产生的适应性免疫防御机制,它应用CRISPR RNA(crRNA)以碱基互补的形式引导相应的Cas蛋白识别入侵的外源基因组,并对其DNA进行剪切,用以保护自身的基因组免受外源核酸如噬菌体、病毒等的干扰和破坏。经过人为改造后,可在真核细胞中实现高度灵活且特异的基因组编辑,通过设计特异性向导RNA(Single guide RNA, sgRNA)序列与靶序列进行碱基配对,从而引导Cas蛋白结合到靶序列处,行使DNA切割功能,然后利用细胞的非同源性末端连接(Non-homologous end joining, NHEJ)或同源重组(Homologous recombination,HR)修复机制对断裂的DNA进行插入缺失(Indel)、修复(Repair)或替换(Replacement)。由于其相对于锌指核酸酶(ZFNs)和转录激活因子样效应物核酸酶(TALENs)技术更易于操作,而且更高效,因而被广泛运用于对基因组特定位点进行靶向编辑。
由于设计的sgRNA会与非靶点DNA序列错配,引入非预期的基因突变,即脱靶效应(Off-target effects)。脱靶效应造成了研究中的许多不确定性,这无疑限制了该技术的应用。因此,研究者希望能开发有效的方法来检测脱靶效应。
在目前主流的脱靶效应评估方法中,有一种方法为GUIDE-seq,其原理是利用一种短的双链寡聚核苷酸(dsODN)标记CRISPR/Cas诱导的脱靶断裂,然后对标签所在的基因组区域进行高通量测序,通过生物信息学分析从而确定脱靶位点。利用该技术可以在基因组范围内检测CRISPR脱靶效应,从而改变了以往先预测假定脱靶位点再检测的思路;与其他的评估方法相比,GUIDE-seq更精确、更灵敏。目前鼓润已掌握了该项技术,简述如下:
1、CRISPR与dsODN tag整合的实验技术及高通量测序建库流程
将靶向于目标基因组位点的CRISPR质粒与dsODN tag以核电转的方式同时转染入真核细胞,CRISPR造成基因组双链断裂后,dsODN tag将整合入断点处,作为后续分析在靶与脱靶情况的标记。转染后3天收集细胞的DNA进行高通量建库。
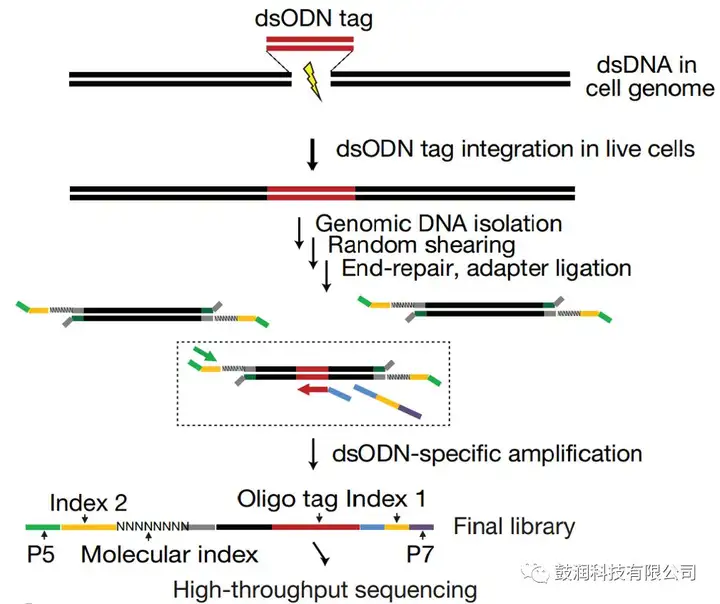
2、GUIDE-seq生信分析方法
1)搭建了高通量测序的数据分析流程
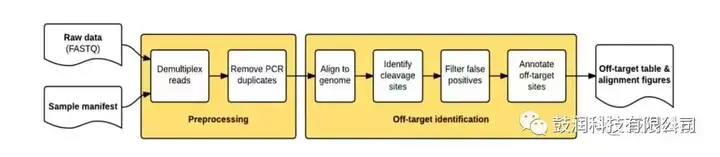
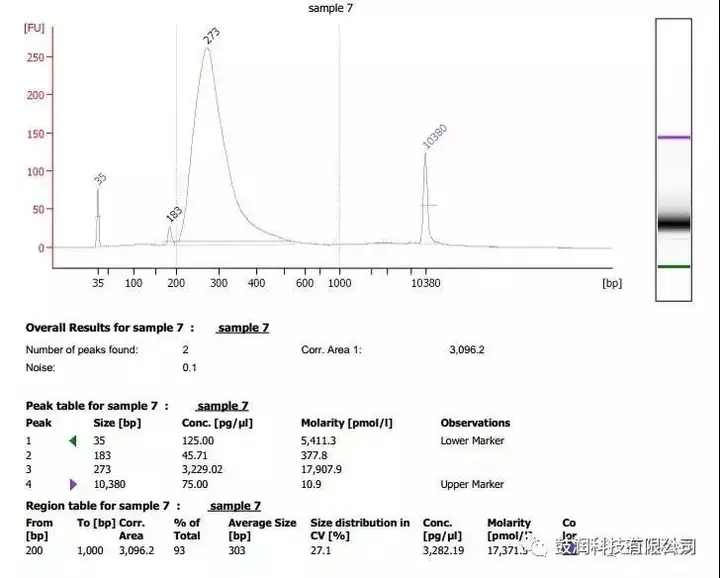
2)利用该技术分析了CRISPR靶向编辑某细胞系基因的在靶与脱靶情况。其中一例样品的分析结果如图4所示:
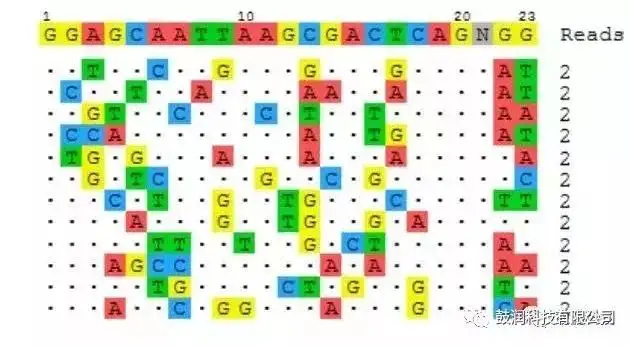
Sequences of off-target sites identified by GUIDE-seq. The intended target sequence is shown in the top line with cleaved sites shown underneath and with mismatches to the on-target site shown and highlighted in color. GUIDE-seq sequencing read counts are shown to the right of each site.
3)利用PCR扩增技术联合Sanger测序鉴定了分析出的脱靶位点
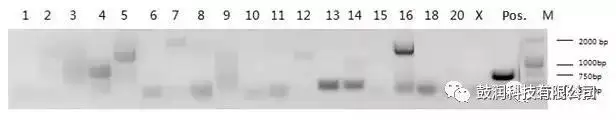
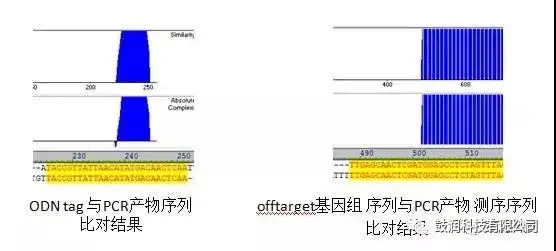
GUIDE-Seq脱靶评估技术的优势分析
舒桐致力于基因组编辑工具脱靶的分析检测工作,为筛选、优化基因组编辑工具的保真性提供标准化的分析。我们脱靶分析具有如下优势:
- 实用性强:能反映CRISPR在真核细胞中进行基因编辑的在靶与脱靶情况,以进行安全性和有效性评价
- 检测通量高:一次能检测多个样本的在靶与脱靶情况,并通过优化的标签设计,降低实际的测序reads数量
- 准确性高:绝大部分检测结果可被验证
- 灵敏度高:能够高效检测出低频脱靶位点,检测低至0.1%的脱靶突变
- 实验难度低:操作过程简单易行
- 细胞适应性强
关于舒桐
如需获得更多信息,请咨询我们:
电话:
400-6309596
15022705442(同微信)
企业官网:
http://www.generulor.com
产品订购/技术支持:
service@generulor.com
参考文献
[1]Tsai, S. Q. et al. GUIDE-seq enables genome-wide profiling of off-target cleavage by CRISPR-Cas nucleases. Nat Biotechnol 33, 187–97 (2015).
