建议检测指标
Th1/Th2/Th3/Tfh/Th17/Treg相关因子
IFN-γ、IL-2、IL-4、 IL-5、IL-6、IL-7、IL-10/CSIF、IL-12/IL-23 p40、IL-12 p70、IL-13、IL-17A/CTLA-8、IL-17F/ML-1、IL-21、IL-22/IL-TIF、TGF-beta 1、TSLP
检测目的: 检测免疫状态,观察疾病进程,判断预后,辅助诊断,药效评价等。
应用举例:
药效评价试验:
用小鼠的腹腔巨噬细胞,经炎症激发因子(LPS)诱导建立了巨噬细胞炎症模型。在该模型中可通过测定被筛选化合物抑制IL-2,IL-4,IL-6,IL-10,IL-17A,TNFα,IFN-γ各细胞药因子表达的程度来评价化合物的抗炎活性。本试验所建立的药物筛选模型是一种灵敏、高效、可靠、适于高通量抗炎药物筛选的细胞模型。
试验方法:
1. 样本制备:接种106小鼠巨噬细胞至每孔培养,分为空白组和LPS实验组; LPS实验组细胞用LPS刺激24小时后, 分别加入不同浓度(分别为10-5 mg/ml, 10-6 mg/ml, 10-7 mg/ml)的1# 和2#号药物,继续培养48小时,收集各细胞培养上清15000 RPM,离心10min,取上清-80保存备用。
2. 检测步骤: 用 Ainplex ®Mouse Th1/Th2/Th17 7-plex检测试剂盒进行检测。加入45ul 捕获微球混悬液入96孔板,分别加入标准品和稀释样本45ul,室温避光孵育1h,洗涤后加入25ul生物素偶联的检测抗体,室温避光孵育30min,洗涤后加入25ul链霉亲和素标记的PE工作液,洗涤后加入 150 ul 洗液,重新悬浮微球。使用流式细胞仪上机检测。
3. 结果分析:用FCAP Array软件分析各个因子检测数据,分析IL-2,IL-4,IL-6,IL-10,IL-17A,TNFα,IFN-γ各因子变化趋势,筛选炎症抑制效果理想药物及其浓度。
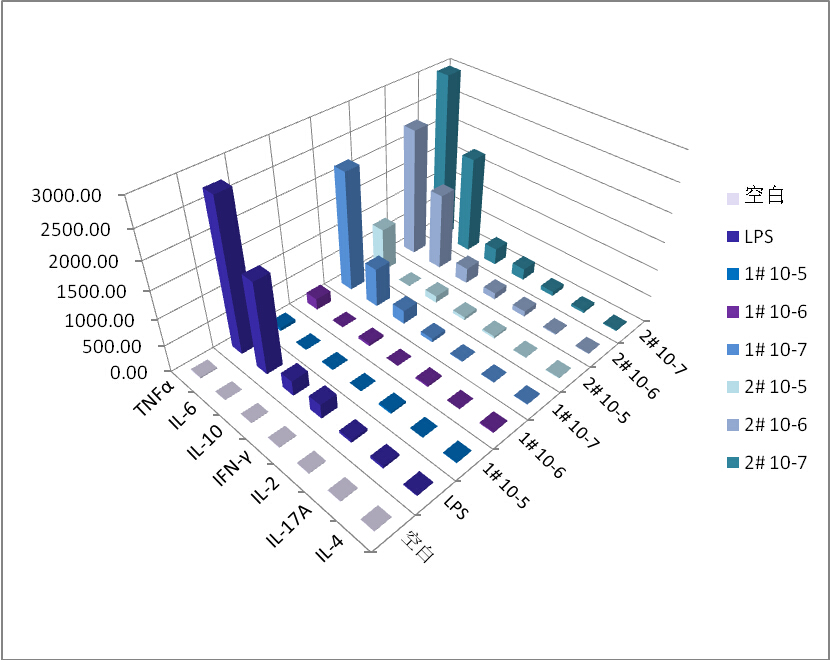
各样本中不同细胞因子含量结果图
结论:
1. 小鼠巨噬细胞用LPS刺激后IL-2,IL-4,IL-6,IL-10,IL-17A,TNFα,IFN-γ均有一定程度的增高,其中TNF-α,IL-6,IL-10,IFN-γ较为明显。
2. 1#药物在10-5,10-6浓度时,对各因子均有明显抑制作用,在10-7浓度时抑制作用明显降低。
3. 2#药物在10-5浓度时,对各因子均有明显抑制作用,在10-6浓度时抑制作用明显降低,10-7浓度没有抑制作用。
4. 总体结果1#药物效果明显比2#药物要好,即抗炎效果更有效。
推荐产品及货号
|
PN |
Name |
Description |
Size |
|
C190010 |
Human Th1/Th2 10-plex |
IFNgamma, IL-1beta, IL-2, IL-4, IL-5, IL-6, IL-8, IL-10, IL-12p70, TNFalpha |
96 T |
|
C191107 |
Human Th1/Th2/Th17 7-plex |
IFN-gamma,IL-10/CSIF,IL-17A/CTLA-8,IL-2,IL-4,IL-6,TNF-alpha |
96 T |
|
C191114 |
Human Th1/Th2/Th17 14-plex |
IFNgamma, IL-1beta, IL-2, IL-4, IL-5, IL-6, IL-8, IL-10, IL-12p70, IL-17A, IL-17F, IL-22, TNFalpha, TNFbeta |
96 T |
|
C191118 |
Human Th1/Th2/Th17 18-plex |
GM-CSF, IFNgamma, IL-1beta, IL-2, IL-4, IL-5, IL-6, IL-8, IL-9, IL-10, IL-12p70, IL-17A, IL-17F, IL-22, IL-33, TNFalpha, TNFbeta, TSLP |
96 T |
|
C281107 |
Mouse Th1/Th2/Th17 7-plex |
IFN-gamma,IL-10/CSIF,IL-17A/CTLA-8,IL-2,IL-4,IL-6,TNF-alpha |
96 T |
|
C281114 |
MouseTh1/Th2/Th17 14-plex |
IFNgamma, IL-1alpha, IL-1beta, IL-2 , IL-4, IL-5, IL-6, IL-10, IL-12p70, IL-13, IL-17A, IL-21, IL-22 and TNFalpha |
96 T |
|
C281118 |
MouseTh1/Th2/Th17 18-plex |
GM-CSF, IFNgamma, IL-1alpha, IL-1beta, IL-2 , IL-4, IL-5, IL-6, IL-10, IL-12p70, IL-13, IL-17A, IL-21, IL-22, IL-23, KC, TNFalpha and TSLP |
96 T |
|
C281116 |
MouseTh1/Th2/Th17 16-plex |
GM-CSF, IFNgamma, IL-1alpha, IL-1beta, IL-2 , IL-4, IL-5, IL-6, IL-10, IL-12p70, IL-13, IL-17A, IL-21, IL-23, KC, TNFalpha |
96 T |
|
C371107 |
Rat Th1/Th2/Th17 7-plex |
IFN-gamma,IL-10/CSIF,IL-17A/CTLA-8,IL-2,IL-4,IL-6,TNF-alpha |
96 T |
参考文献:
[1]Bettelli E, Carrier Y, Gao W,et a1.Reciprocal developmental pathways for the generation of pathogenic effector Th17 and regulatory T cells.Nature,2006,441(7090):235-238.
[2]Chen Z,Lin F,Gao Y,et a1.FOXP3 and RORrt:transcriptional regulation of Treg and Th17.Int Immunopharmacol,2011,11(5):536-542.
[3]Usui T.Transcription factors that regulate helper T cell differen-tiation.Nihon Rinsho Meneki Gakkai Kaishi,2007,30(6):4l9-427.
[4]Hartmann P,Plum G.Immunological defense mechanisms in tuberculosis and MAC-infection.Diagn Microbiol Dis,1999,34:147-152.
[5]Appelberg R. Protective role of interferon gamma,tumor necrosis factor alpha and interleukin-6 in mycobacterium tuberculosis and M.avium infections.Immunobiology,1994,191(4-5):520.
详细信息请点击:www.quantobio.com/Home/Tpl/Public/Uploads/attach/5466f11eb7937.pdf
