分子与细胞生物学,蛋白质组学或者抗体药物开发的过程中,通常需要对蛋白样品进行浓缩,以提高样品的浓度并进行后续的实验分析。尽管蛋白样品浓缩的实验室常规方法有多种,然而,离心浓缩方法由于具有快速、高通量的特点,每次可处理多达 100 – 200个样品,因而越来越普及。
众所周知,蛋白质的性质比较“娇贵”,温度稍高就容易失活,甚至变性而沉淀下来,造成实际有效样品的损失。因此,对蛋白样品进行离心浓缩过程中,需注意控制样品的温度。
也许会有小伙伴问,蛋白质在浓缩的过程中温度会怎样变化呢?会升高还是降低?要想说清楚这个问题,就必须先从离心浓缩仪的原理讲起。
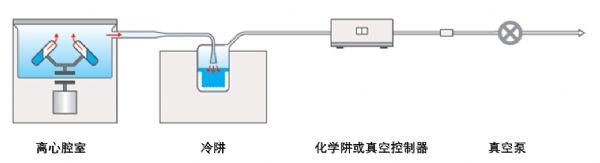
离心浓缩仪主要依靠两个机制加速样品溶剂的蒸发而达到浓缩目的:一是抽真空,二是加热。抽真空是依靠降低样品上方的蒸气压来加速样品中溶剂的蒸发,所以离心浓缩仪都有一个真空泵,同时配备一个冷阱,让冷阱中的低温造成极低的蒸气压。此外,一般非温度敏感的样品,其溶剂也可通过也可通过离心腔室本身配有的加热装置加速挥发,从而更快地被真空系统抽走。
离心浓缩仪原理图
另外,这里还有一个大家经常混淆的概念:冷阱温度和样本温度的关系
图中冷阱的作用是为了使用低温造成极低的蒸气压,通过相连的管道与样品的蒸气压形成压差,把溶剂蒸汽“抽到”冷阱里或通过真空泵排出系统。图中可以看出,冷阱与样本离心区处于完全不同的腔体,因此蛋白样品在浓缩过程中的温度与冷阱没有关系,冷阱温度再低,样品的温度也可能在室温以上。所以冷阱温度不会影响样本温度!
所以,为了保证“娇贵”的蛋白质能够保持活性,我们需要采用其他方式管控离心区的样本温度!
首先,我们来看看蛋白样品离心浓缩过程的温度变化,这将帮助我们认识应当如何调控温度。如前所述,对于蛋白类样品而言,由于其对温度敏感,加热蒸发方式较少采用,而主要是依靠抽真空来加速溶剂蒸发。所以我们这里主要看抽真空条件下样本温度的变化。
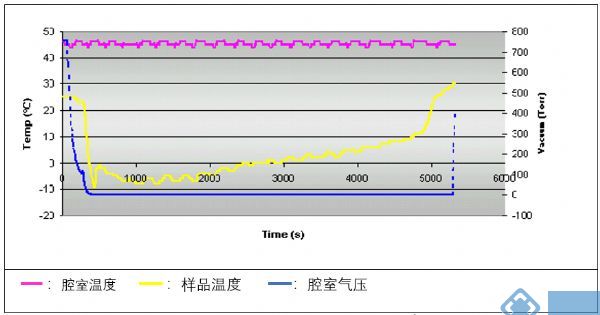
使用单纯的抽真空方式对蛋白样品进行离心浓缩,样品的温度也并非恒定在室温上下,而是经历一个先降温后升温的过程。
在浓缩初期,由于样品中的溶剂快速蒸发会带走大量的热量,样品温度随之而下降,甚至可能降到熔点以下,导致样品冻结,蒸发速率不但没有加快反而变慢(毕竟冰的升华要比水的蒸发慢很多)。随着蒸发的不断进行,样品量越来越少,溶剂蒸发速度也就越来越慢,样品的温度就会慢慢回升。与此同时,离心浓缩仪的马达因为快速旋转而产热,并不断地将热量带到离心腔室中,样品就会被动加热。有数据显示,即使不开启加热功能,马达产热也可能让样品温度达到50℃以上。
离心腔室和样品的温度变化示意图
然而蛋白样品既不能忍受反复冻融,也不能忍受高温。那我们怎么才能做到既快速浓缩,又保持蛋白活性?
您既需要“宝马”,也需要“金鞍”。
这匹“宝马”,就是一台既能升温也能降温的离心浓缩仪。赛默飞的SpeedVac
SRF110就是一款非常适合蛋白浓缩的离心浓缩仪,它的离心室温控范围是-4
– 100℃,且连续可调,它还允许我们编写具有两个段落的程序,使得实验前期和后期的条件有所不同。

Thermo Scientific
SpeedVac SRF110型离心浓缩仪(离心腔)
“金鞍”就是我们的实验条件设置了。我们可以充分利用SpeedVac
SRF110的特性,编写一个程序,让浓缩的前期和后期实验条件不一样。在一开始,样品中的水比较多,蒸发会带走热量,此时我们不宜将温度设得太低,一般可以设到20
– 30℃之间,样品自然降温的同时腔室微微加热,以防样品温度降得过低。如果我们的目的是希望样品中的水分尽可能地少一些,那么在实验的最后大约0.5
-- 1小时左右的时侯,需要主动降温,将样品保持在比较安全的温度范围内,通常建议4
– 10℃。
当然,不同的样品,不同的实验目的和要求需要不同的条件,我们如果能将上面讲的原则活学活用,一定能得到最佳的实验效果。
对以上所讲的产品或应用技巧如有疑问,欢迎点击此处或扫描下方二维码咨询,赛默飞的专业人员将尽快为您解决疑问!