骨髓间充质干细胞BMSCs培养/诱导分化/成骨成脂诱导
产品名称: 骨髓间充质干细胞BMSCs培养/诱导分化/成骨成脂诱导
英文名称: Western Biotechnology Inc
产品编号:
产品价格: 欢迎来电详询023-65316016,023—65316556
产品产地: null
品牌商标: null
更新时间: 2023-07-31T09:56:51
使用范围: null
骨髓间充质干细胞BMSCs培养/诱导分化/
骨髓间充质干细胞(BMSCs)培养
实验动物
4 周龄SD大鼠
主要试剂及仪器
DMEM/ F12培养基、胎牛血清和胰酶均购自美国Gibico 公司,CO2恒温培养箱购自美国Thermo公司。
步骤
a. 取SD大鼠,颈椎脱臼法处死后立即用75%乙醇浸泡,移入超净工作台内,用大头针固定大鼠四肢于工作台面的泡沫板上。
b. 碘酒擦拭四肢,再用酒精棉球擦拭,无菌条件下用灭菌消毒后的镊子和剪刀分离出大鼠股骨和胫骨,剔除骨头表面肌肉,PBS溶液冲洗两遍。
c. 从中折断骨头,用2ml无菌注射器吸取PBS溶液冲出骨髓细胞多次,再用针头吹打,吸管吸入离心管内,1000r/min离心5min,弃上清。
d. 用含10%胎牛血清及青链霉素的DMEM/F12 重悬细胞,接种于无菌培养瓶,置37℃、5%CO2恒温培养箱中培养。
e. 24小时后弃去培养液,PBS冲洗 2~ 3次去除未贴壁细胞,加入培养液继续培养。以后每2~ 3d换液1次,7~ 10d细胞生长融合,经0.25%胰酶消化,1~2传代,其后一般3d传代1次,选取生长良好的第三代细胞进行后续实验。
鉴定
胰酶消化P3代细胞,PBS洗涤2次,分别加入PE标记CD29、CD34、CD45、CD90单克隆荧光抗体,并设同型对照,室温避光孵育,应用流式细胞仪检测BMSCs的表面标志。
细胞形态
BMSCs原代培养过程中,约24小时即可出现贴壁生长,细胞呈圆形、梭形、三角形生长缓慢。换液后细胞增殖明显,出现以梭形为主的多种形态,10~14天70% ~80 %可融合达到传代标准。传代细胞形态单一,呈梭形或扁平型,增殖至细胞融合时呈漩涡状和放射状排列。
骨髓间充质干细胞诱导分化
(1)收集细胞:在显微镜下观察培养瓶贴壁面至70%-80%融合,在超净工作台上操作,先吸除培养瓶中旧培养基,用PBS洗2~3次,50mL培养瓶加入胰酶消化液约1-3mL,按此比例进行消化,晃动使消化液铺均匀,置37度培养箱约2-5min,镜下见细胞收缩变圆或少数脱落后,轻轻振动瓶底使细胞全部脱落,加入2-3mL完全培养基后,轻轻吹打,收集细胞至离心管,1 000 rpm离心5 min弃上清,加培养液,轻轻吹打成细胞悬液。
(2)细胞接种:将上述细胞悬液接种于无菌的6孔细胞培养板,加入2mL完全培养基,放入CO2培养箱 37℃培养 。
(3)细胞诱导:待细胞至50%-60%融合时,加入含50ug/lVEGF、10ug/lFGF、10%FBS的诱导培养液,放入CO2培养箱 37℃培养,连续诱导培养21d,每隔2天换液,每周传代1次。
血管形成实验
(1) 将Matrigel放于4℃融化(不能放于室温,凝固之 后不可以再用)。灭菌的100μL枪头,24孔板冷藏备用;
(2) 开始实验时,从冰箱中取出冷藏的枪头和24孔板,在24孔板每个孔中加入150μL Matrigel。加入胶时注意保持枪头垂直于孔中间位置,Matrigel一直保持放在冰上;
(3) 加入胶后,将整个培养板放入培养箱中,放置30min使凝胶凝固;
(4) 取经不同浓度药物A处理的不同代次的主动脉内皮细胞,消化后用无血清的培养基调整细胞浓度到2×105 cell/mL;
(5) 从培养箱中取出24孔板,每孔加入200μL细胞悬液;
(6) 盖上盖子后放入培养箱培养;
(7) 24h内记录细胞变化。
人间充质干细胞hMSC成骨诱导
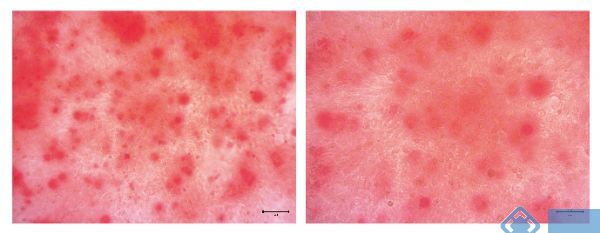
待细胞长至基本融合后,制备完成的成骨诱导培养液(基础培养液+0.1μmol/L地塞米松+ 50μg/mL抗坏血酸+ 10 mmol/L β - 甘油磷酸钠),每隔一天换液一次,诱导21天后再进行矿化结节的茜素红染色。
茜素红染色:
1、诱导后细胞爬片用PBS漂洗2x2min;
2、4%多聚甲醛处理(室温)20min;
3、PBS漂洗,3x2min;
4、茜素红染液染30min;
5、双蒸水冲洗2次;
6、干燥,封片。
3T3-L1脂肪细胞诱导分化成脂肪细胞
3T3-L1细胞融合至约70%时,用0.25%胰蛋白酶消化,传代至6孔培养板中,待细胞接触抑制2d后(诱导分化第0d) ,用经典激素鸡尾酒诱导方案诱导前脂肪细胞分化,加入分化诱导培养基1(0.5 mmol/L IBMX,1 μmol/L DEX、10ug/mL INS),72h后撤去IBMX和DEX,完全培养基中仅含有INS(诱导培养2),继续培养3d后,仅含有10% FBS,2d换液1次,诱导分化8~10d。
注意事项:
1) 待细胞接触抑制后2d加入诱导剂。太早,细胞没有退出生长周期。太迟,细胞诱导后容易漂浮。
2) 3T3细胞株20代以后分化困难,最好挑选5代左右开始诱导分化。将细胞冻存起来,使用时再复苏。
3) 大约需要8~10天,可以诱导分化成功。之后换液处理需要轻缓,以免损失细胞。
细胞细胞形态学观察
倒置显微镜下观察分化前3T3-L1前脂肪细胞呈梭形,胞浆内无脂滴,分化后3T3-L1前脂细胞呈圆形,胞浆内含有大量的脂滴。
威斯腾生物服务流程

威斯腾生物服务项目
| 分子生物学检测 | 蛋白质与免疫学 | 动物实验 |
| 实时荧光定量PCR | 单克隆抗体制备 | 帕金森疾病模型 |
| 免疫共沉淀(Co-IP) | 多克隆抗体制备 | 抑郁症动物模型 |
| ELISA(酶联免疫吸附法)技术 | Western-blot 实验服务 | 脊髓损伤模型 |
| 生化指标检测 | 蛋白双向电泳实验服务 | 脑外损伤模型 |
| 双荧光素酶报告基因检测 | 原核蛋白表达纯化 | 骨神经损伤模型 |
| 染色质免疫共沉淀(ChIP) | 真核蛋白表达纯化 | 心肌缺血模型 |
| GST pull Down | ITRAQ定量蛋白质组学 | 心力衰竭模型 |
| SLAC蛋白组学 | 肺动脉高血压动物模型 | |
| 高血压模型 | ||
| 病毒包装 | 实验课题整体外包 | 粥样动脉硬化模型 |
| 过表达/干扰慢病毒包装纯化 | 整体课题外包 | 大脑中动脉阻塞模型 |
| 过表达/干扰腺病毒包装纯化 | 细胞整体实验外包 | 慢性之气管炎模型 |
| 逆转录病毒包装纯化 | 动物整体实验外包 | 过敏性哮喘模型 |
| 腺相关病毒包装纯化 | 肺炎大鼠模型 | |
| 肝炎-肝硬化-肝癌模型 | ||
| 蛋白芯片 | 原代细胞培养 | 肝纤维化模型 |
| 细胞因子芯片 | 骨髓间充质干细胞培养 | 胆结石模型 |
| BioPlex悬浮芯片 | 脂肪干细胞培养 | 急性胰腺炎模型 |
| 生长因子芯片 | 心肌成纤维细胞培养 | 急性肾衰竭模型 |
| 炎症因子芯片 | 软骨细胞培养 | 体内血栓模型 |
| 血管生成因子芯片 | 血管内皮细胞培养 | 关节炎模型 |
| 凋亡因子芯片 | 神经元细胞培养 | I型和II型糖尿病模型 |
| 趋化因子芯片 | 内皮组细胞原代培养 | 裸鼠成瘤 |
| HuProt TM 20K人类蛋白组芯片 | 基因编辑动物 | |
| 电生理相关服务 | 动物整体实验服务 | |
| 膜片钳实验 | ||
| 细胞生物学检测 | 高通量测序 | 代谢组学 |
| 细胞原代培养 | mRNA测序 | 气相色谱GC/MS |
| MTT检测 | LncRNA测序 | 液相色谱LC/MS |
| 细胞凋亡检测 | 全基因组测序 | 核磁共震NMR |
| 细胞周期检测 | RNA-Seq测序 | |
| 细胞克隆形成实验 | 外显子测序 | 影像学相关实验 |
| Transwell细胞迁移/侵袭 | 16s扩增子测序 | Micro-CT |
| 流式分选 | Small RNA测序 | 小动物活体成像 |
| CCK8/XTT检测 | 宏基因组测序 | 核磁共振 |
| 台盼蓝检测细胞活性 | 单细胞测序 | PET-CT |
| 药物筛选细胞学实验 | circleRNA测序 | |
| 细胞粘附性检测 | 甲基化测序 | 基因编辑动物 |
| 细胞划痕实验 | 条件性敲除小鼠/大鼠 | |
| 细胞生物学整体实验 | 全基因敲除小鼠/大鼠 | |
| 细胞成管实验 | ||
| 病理检测 | CRISPR/Cas9细胞敲除/敲入 | 基因芯片 |
| 扫描电镜 | 基因定点突变细胞系 | LncRNA芯片 |
| 透射电镜 | 单基因敲除细胞系 | miRNA芯片 |
| HE染色 | 多基因敲除细胞系 | mRNA芯片 |
| 免疫组化 | 目的基因敲入细胞系 | 甲基化芯片(限人和小鼠来源样本) |
| Tunel(原位末端凋亡法)检测 | 报告基因敲入细胞系 | SNP芯片(限人和小鼠来源样本) |
| 激光共聚焦 | miRNA/LncRNA敲除细胞系 | |
| 免疫荧光 | ||
| Masson染色 | TUNEology 波长可调检测卡盒-->
|