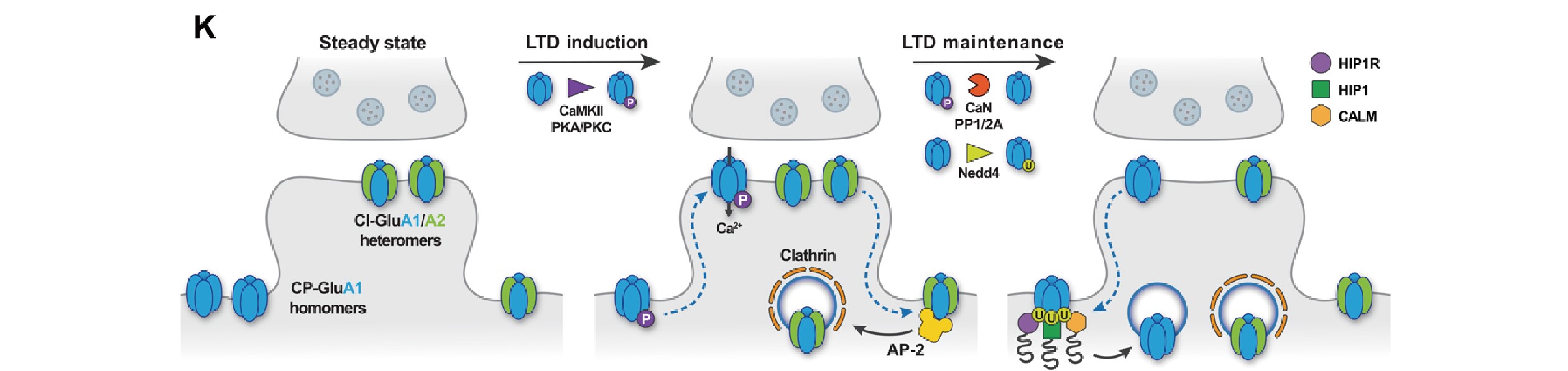
在LTD发生过程中,含有GluA1同聚体的钙不通透性AMPAR(CI-AMPARs)会通过网格蛋白介导的内吞作用进行内化,而含有GluA1/A2异聚体的钙通透性AMPAR(CP-AMPARs)先被招募到突触,介导了钙内流。在LTD维持阶段,这些CP-AMPARs最终需要被移除,然而移除机制暂不明确。
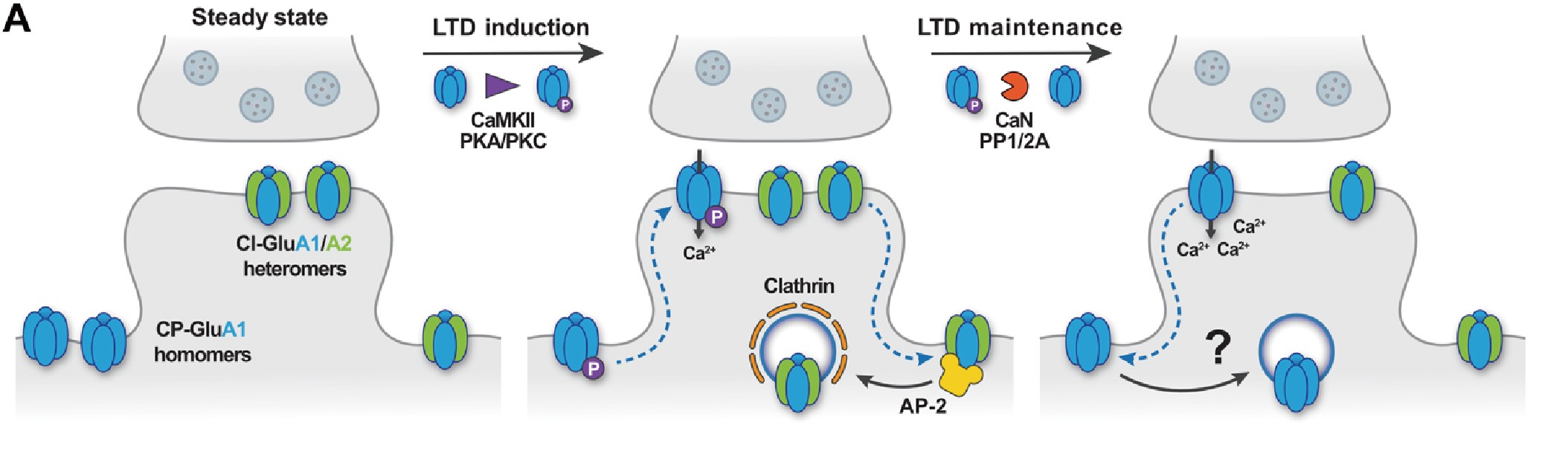
2022年5月25日,德国莱布尼茨研究所Tanja Maritzen和Volker Haucke研究团队借助转基因鼠模型、病毒载体介导的基因表达调控技术、分子生物学技术及成像技术等多种手段发现阿尔兹海默症风险因子CLAM可双向调控突触可塑性及调节学习能力的核心内吞机制。并在Science Advances杂志上发表研究论文,标题为:Selective endocytosis of Ca2+-permeable AMPARs by the Alzheimer’s disease risk factor CALM bidirectionally controls synaptic plasticity。

首先,研究者分离小鼠的突触小体进行胰蛋白消化筛选,以识别突触后选择性富集的内吞蛋白。结果发现,CALM(网格蛋白装配淋巴样骨髓白血病蛋白) 作为一种内吞蛋白,选择性富集于AMPAR内吞发生的突触后区域。
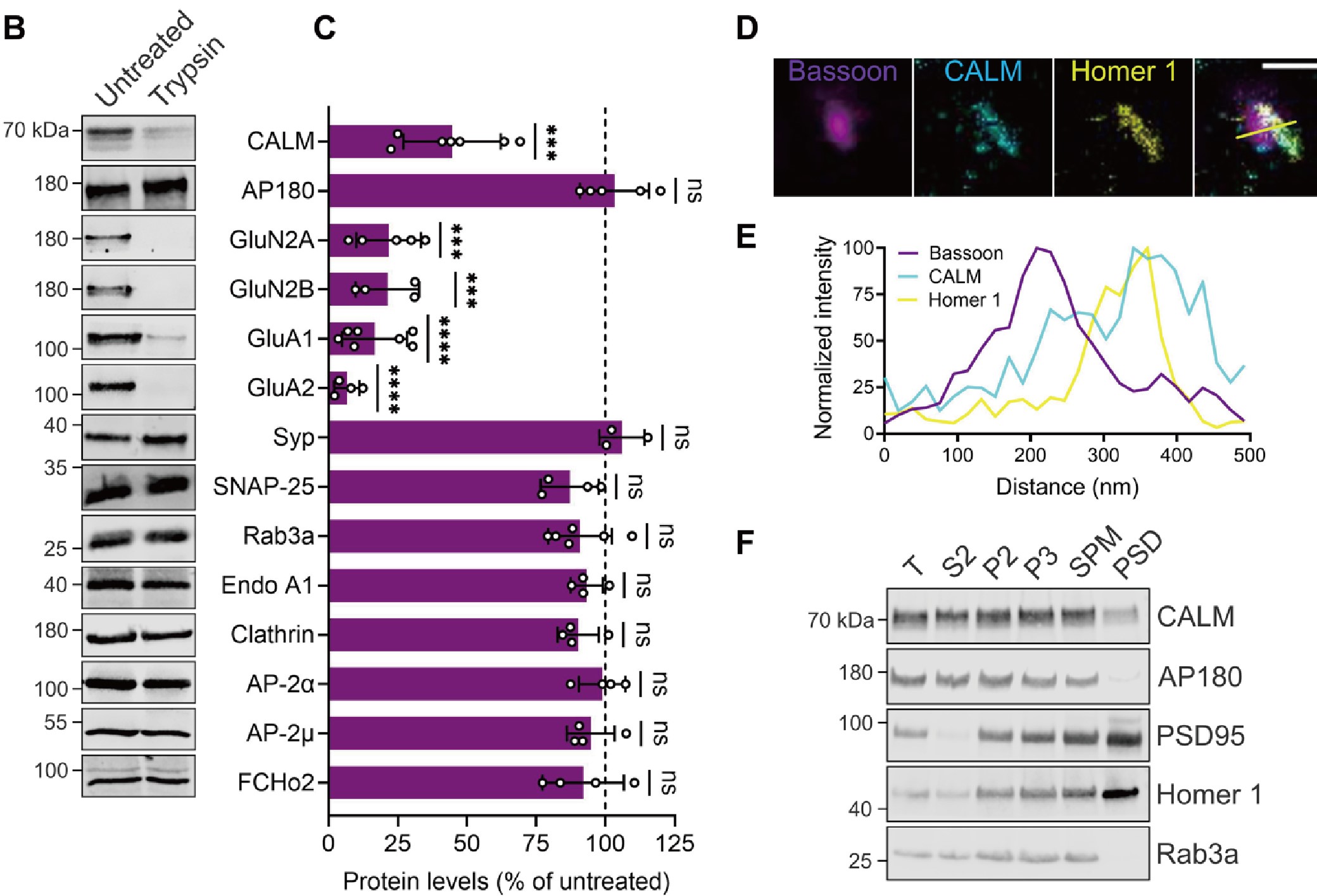
随后,特异性在皮层和海马兴奋性神经元中敲除CALM(CALM KOEMX小鼠)发现,经单次theta脉冲刺激(theta burst stimulation,TBS)后LTP显著增加;经低频刺激(LFS)诱导的LTD减少。免疫组化结果显示,特异性在皮层和海马兴奋性神经元中敲除CALM可导致部分含GluA1的AMPARs重新分配到神经元表面。
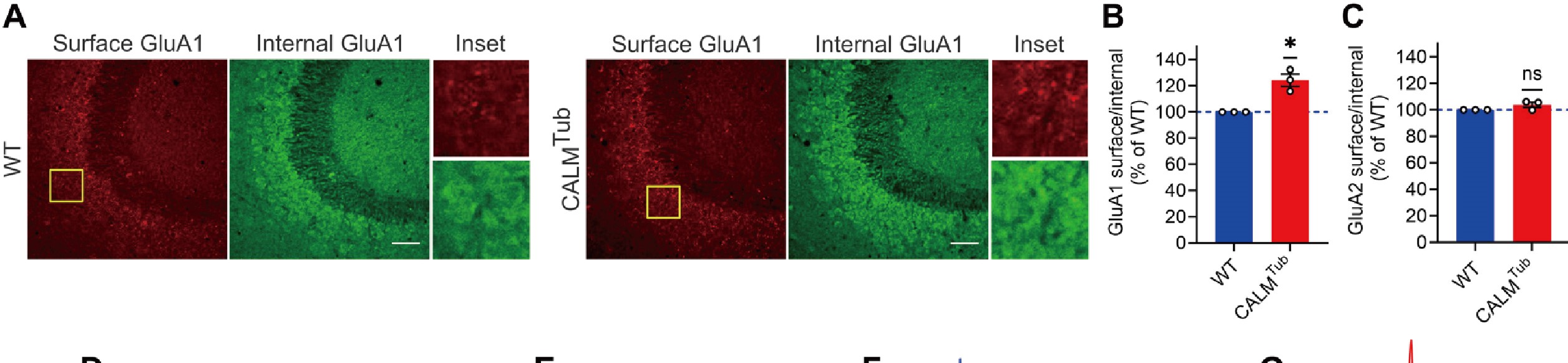
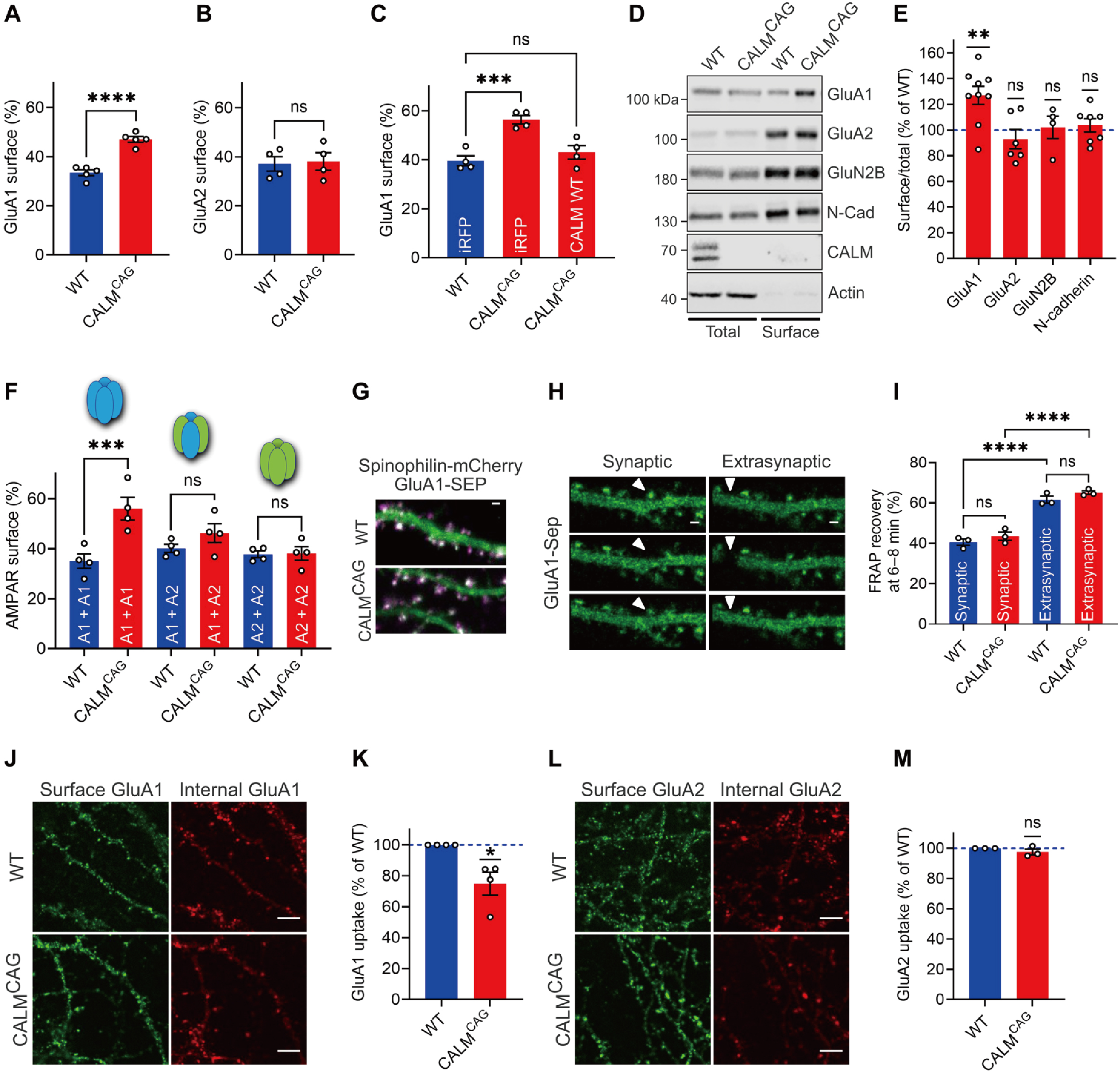
研究者借助AAV介导CALM在CALM敲除小鼠过表达,发现了CALM可特异性调控含GluA1的AMPARs表面水平。成像结果显示,CALM可选择性地促进GluA1在突触后膜的内吞作用,神经元缺失CALM则会导致海马神经元GluA1同体的内吞作用。提示了CALM通过选择性促进CP-AMPARs的内吞作用,在突触可塑性中起双向调控的作用。
借助Morris水迷宫发现,CALM KOEMX小鼠表现出更强的空间学习能力。这些提示了突触后富集的内吞蛋白CALM在LTD和LTP阶段发挥不同作用,并调节空间学习能力。
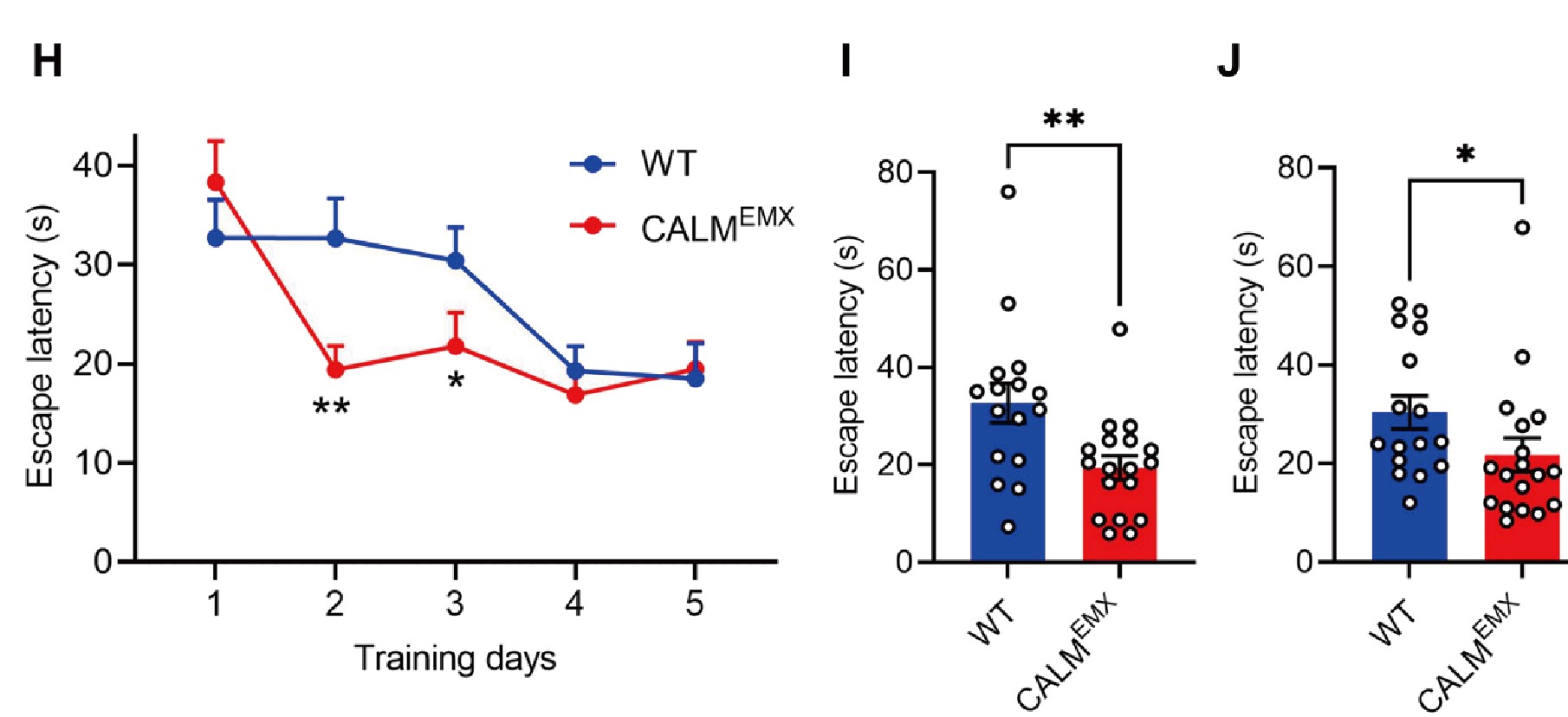
最后,研究者探讨CALM介导GluA1同聚体内吞作用的分子机制,发现GluA1的内吞作用是由CALM介导的膜重构驱动的。CALM 通过依赖泛素结合结构域ANTH的识别选择性地促进泛素化CP-AMPAR 的内吞作用。提示了CALM和包含ANTH结构域的相关蛋白是决定CP-AMPARs表面水平,双向调控突触可塑性及调节学习能力的核心内吞机制。
和元生物可为研究者稳定提供文中使用AAV和慢病毒载体,助力基因表达调控技术!
