在科研和细胞工程等领域中构建稳定表达细胞株,经常需要实现多个基因的稳定共表达,目前常用的策略是多重感染、多重分离筛选等,然而这种方式存在很多弊端:①真核细胞中可使用的筛选标记数量有限;②实验周期长;③同时使用多个不同的筛选基因可能对细胞产生不利影响;④多基因串联,病毒包装效率低等;以上问题为筛选多基因共表达的稳转株在时间和成本等方面提出了挑战。因此,有必要开发新的技术手段解决以上问题。
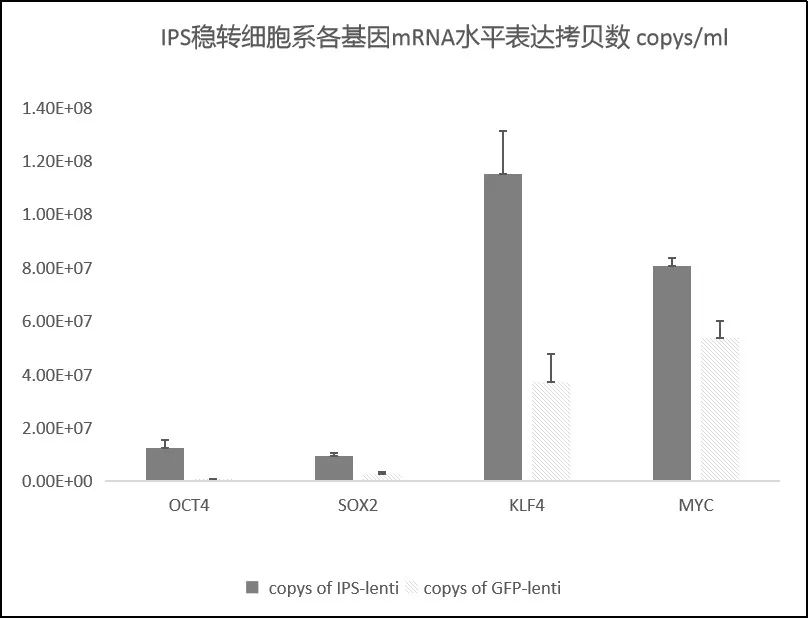
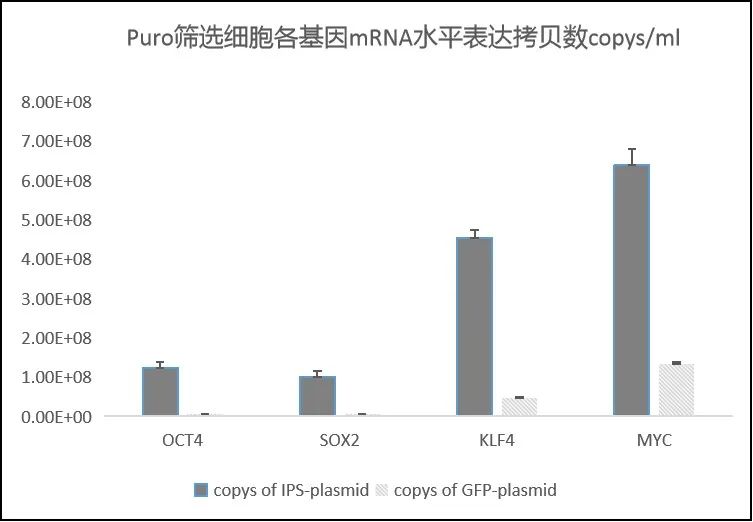
维真生物建立了一种可简单快速地实现多基因共表达的分裂筛选系统! · 分裂筛选标记原理 研发路线 利用慢病毒快速构建IPS稳转株 目前,我们已经利用上述系统,成功获得了共表达四种转录因子(Oct3/4、Sox2、c-Myc和Klf4)的IPS稳转细胞系。 首先,我们将四种转录因子分成两组分别构建到前面所述的双慢病毒载体中,得到pLent-Ef1a-Oct4-P2A-Sox2-cmv-N-Puro(简称IPS-N-Puro)和pLent-Ef1a-Klf4-P2A-Myc-cmv-C-Puro(简称IPS-C-Puro)的慢病毒质粒。随后将这两个慢病毒质粒共转到293A细胞中,通过Puro筛选,观察细胞生长情况。如下图所示设置实验组与对照组,我们发现在Puro加压后空细胞组细胞大量死亡,而实验组与对照组中细胞存活率较高。这一结果说明,有大量的双慢病毒载体进入了同一细胞中,抗生素基因得到了正常表达,大量细胞得以存活下来。 接着,我们将上述两个慢病毒载体分别包装成慢病毒,进行293A细胞的共感染,如下图所示设置实验组和对照组,感染72小时后,加Puro进行筛选,我们发现,空白组细胞(5)和单一慢病毒感染组(2、3)的细胞,出现大量死亡,而“摄取”到双病毒的实验组(1)和GFP组(4),细胞存活率明显高于两病毒单独感染组,在筛选一周后我们成功获得了大量稳转株细胞。 慢病毒 载体 滴度 IPS-N pLent-Ef1a-Oct4- 7.19E+08 IPS-C pLent-Ef1a-Klf4- 1.87E+09 同样地,我们对两病毒共感染组与GFP慢病毒对照组中细胞中的四种转录因子mRNA水平的表达情况进行了定量检测,结果与质粒转染所得结果基本一致,两病毒共感染组细胞中四种转录因子的mRNA表达量都要明显高于GFP对照组,结果同样验证了上述结论,四基因共表达的稳转株细胞构建成功。 结语 维真生物成功建立了一种可实现分裂筛选标记的慢病毒稳转系统,能够利用一个筛选标记选择多个转基因,使多基因的共同表达更加简单方便,并能在短时间内完成多基因的稳转细胞系构建。目前,我们已经利用该系统成功获得了稳定表达四种转录因子的诱导性多能干细胞的稳转细胞株。此外,该系统还可以在CRISPR/Cas9基因组编辑中,用于双转基因或双等位基因敲除的阳性细胞选择。欢迎各位老师垂询!更多服务详情,欢迎访问官网www.wzbio.com.cn查询【首页-附加服务-分裂筛选标记系统】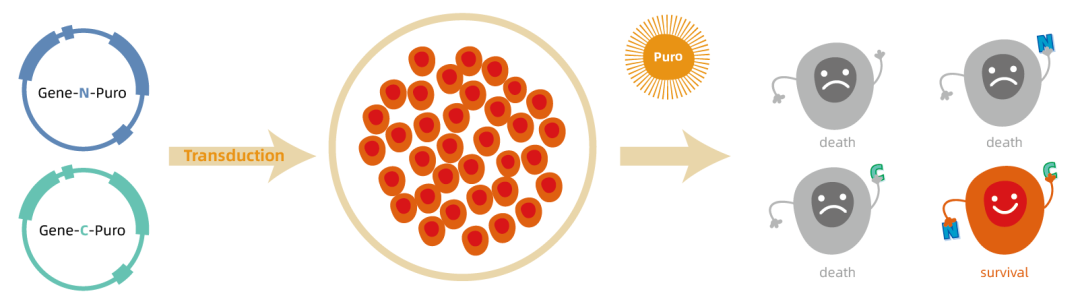


-Puro
P2A-Sox2-cmv-N-Puro
IU/ml
-Puro
P2A-Myc-cmv-C-Puro
IU/ml