-box; overflow-wrap: break-word !important; vertical-align: middle; display: inline-block; line-height: 0;">
(Gessler D J et al. Methods Mol Biol. 2019 )
注:本期分享来源于文献,如有错误及不足之处,欢迎各位老师批评指正。
[1]Ocana-Santero G , Javier Díaz-Nido, Saúl Herranz-Martín. Future Prospects of Gene Therapy for Friedreich's Ataxia[J]. International Journal of Molecular Sciences, 2021, 22(4):1815.
[2]ZMD Jingdong, XMD Huangui. Brain Stereotaxic Injection[J]. Springer New York, 2014.
[3]Cristina, D, Peterson, et al. AAV-Mediated Gene Delivery to the Spinal Cord by Intrathecal Injection.[J]. Methods in Molecular Biology, 2019.
[4]Gessler D J , Tai P , Jia L , et al. Intravenous Infusion of AAV for Widespread Gene Delivery to the Nervous System[M]. 2019
前期,我们给大家分享了在神经系统研究中AAV血清型和启动子的选择『是干货啊!神经研究中启动子和血清型这样选!』,本期我们与各位老师继续分享关于AAV注射方式的有关内容。目前AAV在神经系统研究中的注射方法主要有以下几种:脑实质内注射、静脉注射、脑室注射(ICV)、枕大池内注射(ICM)和鞘内注射(IT),其中ICV、ICM和IT注射是通过脑脊髓液进行传递。每种注射方式各有优缺点,研究者可根据具体的研究对象以及实验方案,选择适合的注射方式,推荐进行预实验对实验效果做初步测试,以得到更优的选择方案。
表1.四种常用AAV神经给药特点
(Ocana-Santero G et al. ,International Journal of Molecular Sciences, 2021)
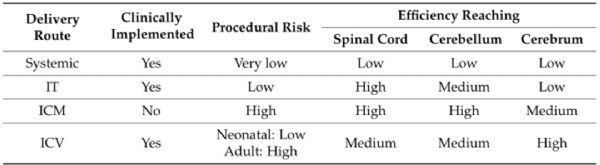
脑立体定位注射,相比其他注射方式靶向性强,注射病毒体积小,但是侵入性也强,且对操作者具有很高的要求。在立体定位手术时,颅骨上常用的注射参照点是前囱,也就是中矢状冠状缝的交叉点(下图B中的十字交叉点)。具体操作步骤如下:
1. 实验动物称重,进行麻醉;
2. 待实验动物完全麻醉后,用剃毛器将动物头顶眼睛至耳朵之间的毛发剃除干净;
3. 将麻醉后的实验动物固定于脑立体定位仪上;
具体操作为:实验动物眼部涂抹青霉素眼药膏以保护其双眼;将门齿挂在门齿挂钩上,确保头部保持固定;检查左右耳杆是否在同一水平上,将左右耳杆通过外耳道插入实验动物耳内。实验动物固定好的标准为:鼻对正中,头部不动,提尾不掉,目测大脑放置水平;
4. 手术:用碘伏/ 无色葡萄糖氯己定溶液对实验动物头皮进行消毒清理,用手术刀沿中间位置剪开头皮,用镊子对表面的结缔组织进行清理,暴露实验动物的颅骨表面;然后进行调平,首先找到前囟这个坐标,并将其归零,然后向左右调平,使左右两侧处于同一水平,调整前后囟,使前后囟也在同一水平;
5. 病毒注射:通过查询实验动物的脑立体定位图谱确定待注射脑区的位置(下方图片是大鼠和小鼠的脑谱),并确定其坐标值,即ML 值(X 轴)、AP 值(Y 轴)、DV 值(Z 轴);根据目标脑区设定好坐标,移开注射针,用颅骨钻开窗( 由于颅骨薄, 故务必注意颅骨钻的力度!!), 操作时避免伤及脑组织;微量注射器吸取病毒液,随后固定在定位仪上,根据设好的坐标进行病毒注射,注射速度控制在0.1-0.15μL/min,注射剂量视具体实验而定。注射完毕,留针10min,以便病毒液充分吸收,然后慢慢回针;
6. 缝合头皮并消毒, 完成脑定位注射; 将动物从脑立体定位仪取下, 回笼待苏醒; 动物苏醒后,正常喂养, 病毒注射后2-4 周可检测转基因的表达。
提示:若手术麻醉时间较长,建议不要用酒精消毒,防止酒精挥发导致动物体温过低而死亡。手术过程和苏醒过程注意保暖。
图1. 脑立体定位注射示意图
(Van der Perren A et al. JOVE-J VIS EXP. 2016)
与系统注射和实质内注射相比,鞘内给药是一种具有较低剂量要求的微创替代方法。步骤如下:
1、使用毛巾覆盖在小鼠头部和背部,露出髂嵴以下的腰部区域;用非惯用手的拇指和食指抓住鼠的髂骨(髋骨),手的顶部轻轻放在小鼠身体和头部上,使其保持平静。
注:在髂骨上的握力应该足够强,以固定小鼠的腿部活动,并使腿部向外和向下伸展。
2、使用惯用手食指从腰椎到骶部沿脊柱轻轻按压,同时使用非惯用手轻轻上拉小鼠,以打开椎节之间的空间,方便进针。
3、将1 ¼”号针的斜面指向小鼠头部,然后将针以70°角插入脊柱中线的腰椎处,当感觉针碰到骨头时,将针的角度调整到30°夹角,并将针插入椎节之间。
注:需多次尝试找到合适的进入点,针头进入脊柱后推针没有阻力,尾巴或后腿的反射性弹跳出现时,说明已正确入针。
4、轻轻压下注射器的活塞,将5-10μL的AAV病毒悬液注射至蛛网膜下腔。
注:注射时间控制在10-30s较好,速度太快会导致小鼠后腿抽筋,该现象会在60s内消失。
5、注射后,将针180°旋转1-2次,然后将针从脊柱中取出。
6、小鼠放回笼子观察,确认恢复正常运动功能。
注:此法适用于成年小鼠或大鼠。
系统性给药方式,侵入性较小,但是相比其他注射方式特异性也较差,因此所需病毒体积更大。步骤如下:
1、调整光源位置以便照亮显微镜区域,中等强度的光照为佳。
2、将一个新生幼鼠直接置于冰上1-3min,进行麻醉。
3、当动物在冰上麻醉时,在注射器中注满AAV病毒,注射体积不应超过100μL。
4、在显微镜下观察幼鼠。用不持注射器的手的食指放在幼鼠口鼻处,中指放在耳芽处,以便拉伸幼鼠的皮肤,可见颞浅静脉。
5、确定颞浅静脉。可通过皮肤看到位于耳芽前部,周围毛细血管下部,有一条隐约可见的静脉血管,从背部到腹部,汇入颈静脉,这就是颞浅静脉。
6、注射器针尖斜面插入颞静脉。可以看到针尖斜面通过皮肤的以后被血填充。轻压注射器,并注意幼鼠脸侧面的静脉变白。
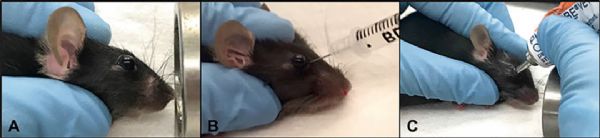
1、注射异氟醚对小鼠进行麻醉,使用非惯用手手掌握住小鼠背部,将拇指放在气管正侧面,头部皮毛拢至手掌,使小鼠眼球凸起。
2、将手腕支撑在稳定的表面上,用拇指、中指和无名指握住注射器,将食指放在柱塞上方。
3、对小鼠施加轻微压力使眼睛凸出,针头对准内眦,斜面朝外,将针头以45°插入眶后窦中心约5mm;
4、使用0.5ml 28G注射器缓慢注入150-200μL病毒悬液;
5、缓慢地取出针头,确保针头不会划伤眼角膜。使用无菌纱布止血,并在眼睛上涂抹药膏助其恢复。
6、注射后,将小鼠放回笼中恢复直至清醒。
(Gessler D J et al. Methods Mol Biol. 2019 )
1、将小鼠放入约束器中,使尾巴从开口处露出。避免过度限制小鼠,以免导致其呼吸受阻。
2、在尾部涂抹70%异丙醇。
3、将小鼠尾巴拉直,可看到尾巴两侧各有一条侧脉。
4、将针尖以30°角插入侧静脉中。一旦针尖穿过了静脉的一半,重新调整针头,使其与静脉的长度一致(图3c)。如果针头插入正确,则按压注射器注射时应无阻力。
5、使用0.5ml 28G注射器缓慢注射300μLAAV病毒悬液,此时静脉颜色会变白,大约4s后,颜色恢复正常。
6、小心将针头取出,用吸水纱布按压注射部位10秒进行止血。
7、将小鼠放回笼子。

地 址: 高新区港源四路416号
联系人: 展经理
电 话: 400-077-2566
传 真: 0531-88896821
Email:market@wzbio.cn




