潮汐反应器技术在以VERO细胞为载体生产日本脑炎病毒(JEV)疫苗领域的应用
背景介绍
日本脑炎病毒(JEV)于1934年首次从一例致命的人类病例的大脑中分离出来。虽然有症状的日本脑炎很少见,但病死率可高达30%。在那些幸存下来的人当中,30-50%遭受终身性的智力、行为或神经问题。东南亚和西太平洋地区有30多亿人可能受到JEV感染,因此接种疫苗是有效预防措施。
日本脑炎疫苗的开发始于20世纪40年代福尔马林灭活小鼠脑源性疫苗。尽管在诱导保护性免疫应答方面有效,但最后一批小鼠源疫苗已于2011年5月用完,因为当今国际乙脑疫苗开发标准不再允许这种生产方法。
在这篇white paper中,我们描述了使用填充床细胞培养系统开发日本脑炎疫苗的过程。我们提供了一种具有成本效益的生物处理解决方案和一种适用于替代小鼠脑源性疫苗的制造工艺。
概述
使用含有胎牛血清的MEM培养基,将VERO细胞接种在充满片状载体(BioNOCⅡ)的500mL潮汐式生物反应器细胞培养瓶中(VacciXcell CelCradle-500AP)。在接种培养96小时后,可以收获的细胞数量为1.2x109。在培养倍增时间方面,细胞在潮汐式生物反应器CelCradle (CC)上培养需要32小时,而在T-175培养瓶上则需要40小时。这一数据结果清楚地说明了潮汐式生物反应器技术能够为细胞提供更好的生长条件,原因是此项技术增加了细胞和培养基之间营养成分以及氧气的有效交换。
使用日本脑炎病毒株以感染倍数(multiplicity-of-infection MOI) 0.01感染VERO细胞。在病毒感染后,每天收获一部分病毒液,并补充等量新鲜培养基,能连续培养收获超过7天的病毒液。收获液的病毒滴度采用“黄金标准”,即斑检测法(Plaque Assay)为检测病毒感染颗粒滴度的方法测定。最终,1台潮汐式生物反应器CelCradle能可获收1.11x1011 plaque-forming unit (pfu)总体病毒滴度。
材料
设备 | 细胞系/产品 | 完全培养基 | 接种细胞数 |
Celcradle - 500 AP | VERO细胞系/ JEV | MEM/ 10%FBS/ 2mM L-Glutamine | 1.4 x108 |
表1:执行第一阶段-Vero单元扩展所需的材料.
第一阶段:Vero细胞的接种和增殖
使用胰蛋白酶消化法从4个T-175细胞培养瓶上收获细胞,收集起来,400 x g,3 min离心洗涤,共收获1.4x108个细胞,添加120ml完全培养基,吹打混匀,将细胞悬液转移到一个带白帽的潮汐式生物反应器CelCradle- 500AP一次性培养瓶中。将此细胞培养瓶倒置,进行细胞贴壁接种,注意要使片状载体全部浸没于细胞悬液中。将培养瓶置于37°C二氧化碳培养箱中孵育3小时,每15-30分钟拿出细胞培养瓶,轻轻摇晃,使细胞均匀接触营养成分和氧气。1小时后,播种效率达99.51%。为使附着细胞增殖,向培养瓶添加培养基体积达500mL,与装有2.2 L培养基的灌注瓶连接,置于平台上,参数设置如下:
CelCradle培养基体积 | TideMotion潮汐式的参数 | 增殖周期 |
500mL | Uprate: 1 mm/sec Uphold: 10 sec Downrate: 1 mm/sec Downhold: 10 sec | 96小时 (4天) |
灌注瓶培养基体积 | 灌注参数 | |
2200mL | Pump 1 Volume: 1999 ml Cycles/Day: 24 Schedule: 1111111 |
表2:第一阶段celbradle阶段生长和灌注参数概述:vero细胞扩展
每天取载体进行:(1)CVD计数;(2)甲醇/台盼蓝染色法观察细胞增殖及在基质中的分布。
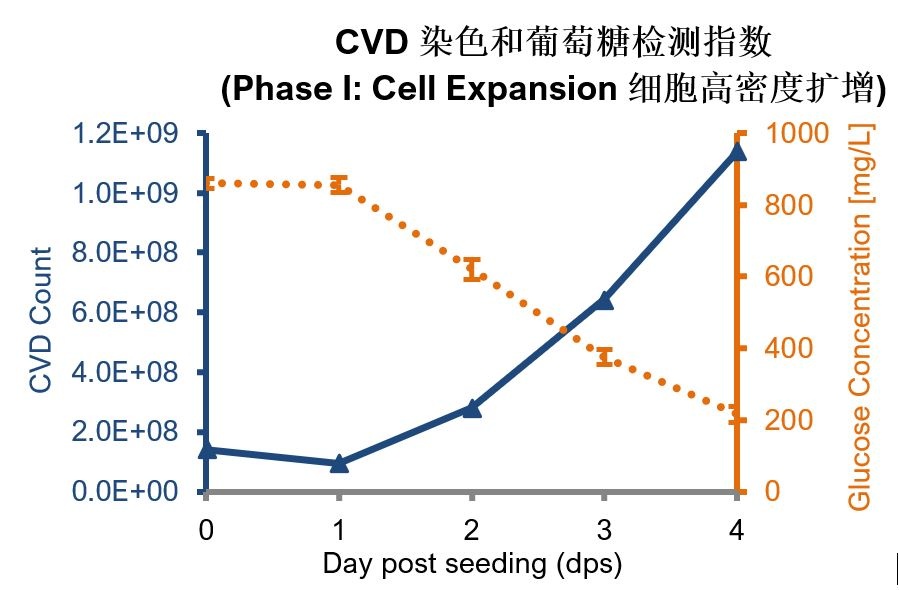

图1:(顶部)每天使用CVD对CelCradle-500AP瓶中至少10个随机选择的载体进行细胞计数。(下):固定3个载体甲醇,RTP染色1x台盼蓝染色5min, PBS冲洗2次,显微镜下观察。
第二阶段:病毒接种和传播
VERO细胞感染JEV, MOI为0.01,总体积为500ml。病毒接种及7天传播参数如下:
表3:执行第二阶段的CelCradle阶段参数概述。
采集含有病毒产品的培养基,并在七天的不同时间用新鲜培养基替换:
表4:第二阶段七天内收获和新鲜介质补充时间点一览表。

图2: (上)每天用葡萄糖细胞仪测量血糖浓度。蓝色箭头表示上清液收获(470mL)与相同数量的新鲜培养基更换。葡萄糖[G;绿色字体]及/或谷氨酰胺[Glut;绿色字体]及/或碳酸氢钠[SB;紫色字体)。(下) :0dpi和7dpi随机从CelCradle瓶中抽取3片载体。使用甲醇固定,添加1x台盼蓝,染色5min,快速热处理, PBS冲洗2次,在显微镜下观察。
第三阶段: 斑检测法(Plaque Assay)测量JEV毒液滴度
从感染后的第2天到第7天,每天采集含病毒上清液。完成所有的收获之后,将含病毒上清液保存在-80°C。病毒滴度分析测定使用“黄金标准”,即斑检测法,或者其它已经公布开放了的方案。
图3:CelCradle-500 AP,斑块形成单位的滴度(感染性JEV)。
表5CelCradle - 500 A,收获液的滴度(感染性JEV)。
2D和3D细胞培养:病毒生产量的比较
对比二维培养如T-175细胞培养瓶以及三维培养如潮汐式生物反应器CelCradle,对病毒的繁殖生产的影响,一个潮汐式生物反应器CelCradle细胞培养瓶生产的JEV含量相当于21个T-175细胞培养瓶生产的JEV病毒滴度含量。

讨论
潮汐式生物反应器技术能确保细胞的高密度扩增、增殖以及最终收获产品的高产。它的独特之处在于创造了一个结合高氧传递和低剪切力的利于贴壁细胞增殖的环境。预期的优良药品制作规范生产模式制生产(Good Manufacturing Practice)量将要求达到一个500L的生物反应器规模,并且还需要更加广泛性的优化生产工艺,以降低产品成品,增加产品产量,另外,还需要确定关键的工艺参数,以提高GMP模式制生产过程水平。在这里,由于潮汐式生物反应器CelCradle采用了大型潮汐式生物反应器TideCell相同的潮汐反应技术原理,并且因其占地面积小且体积小,可以更加灵活地应用于生产工艺的优化以及新工艺的开发。
在这项概念性验证研究中,我们已经证明潮汐式生物反应器CelCradle-500AP可以应用于Vero细胞的培养和JEV疫苗生产工艺。1个潮汐式生物反应器CC-500AP培养瓶的总病毒产量为1.06x1011 pfu (plaque assay));然而,一个潮汐式生物反应器CC-500AP培养瓶的体积与一个T-175培养瓶相似,但前者的病毒产量是后者的21倍的。值得注意的是,在未优化的培养条件下,依然收获了滴度如此高的终产品,继续优化培养条件,可以预料会收获更加令人振奋的结果,后续的试验将进一步探索以及确定Vero细胞培养和JEV生产工艺的最佳的操作参数以便可以提高产量。
© 2019 Esco Aster Pte Ltd. All rights reserved. All trademarks are the property of Esco unless otherwise specified.
