基于需要递转不同种类核酸/蛋白类型研究,在细胞转染环节,研究者们常碰到如下三类问题:
1、细胞对化学试剂较为敏感,转染后,细胞活率下降或死亡;
2、研究常用细胞类型较多,不同类型细胞,转染效率差异较大,导致单个转染试剂或者实验流程,无法满足实验需求;
3、递转多种类型核酸或蛋白,需要挑选对应的转染试剂,并且需要大量实验优化,才可以得到较高的转染效率。
有没有一款化学转染试剂,可以同时应对常规到难转染的细胞类型,有着较低的细胞毒性,并且适用于多种核酸/蛋白类型递转呢?兼具多重功能、高性能的TransIT-X2®转染试剂,可同时应对常见细胞及难转染细胞类型,避免条件摸索、大量的重复性实验,轻松地得到您理想的实验结果。
● 已验证在大多数细胞类型中(如贴壁/悬浮细胞、原代细胞、神经细胞等),都有着优异的转染效率、低毒性(特别相对于形成脂质体复合物的Lipofectamine®系列试剂)、高性能的表现;
● 适用于多种研究领域,包括不限于干细胞研究、基因编辑CRISPR研究、RNAi基因干扰/沉默、稳转细胞株构建、低毒性的转染实验、共转染实验等;
● 允许高效且稳定的同时递转多种核酸/蛋白类型,包括不限于质粒 DNA、siRNA/miRNA 和 CRISPR/Cas9 组分。
图1、Mirus产品年鉴
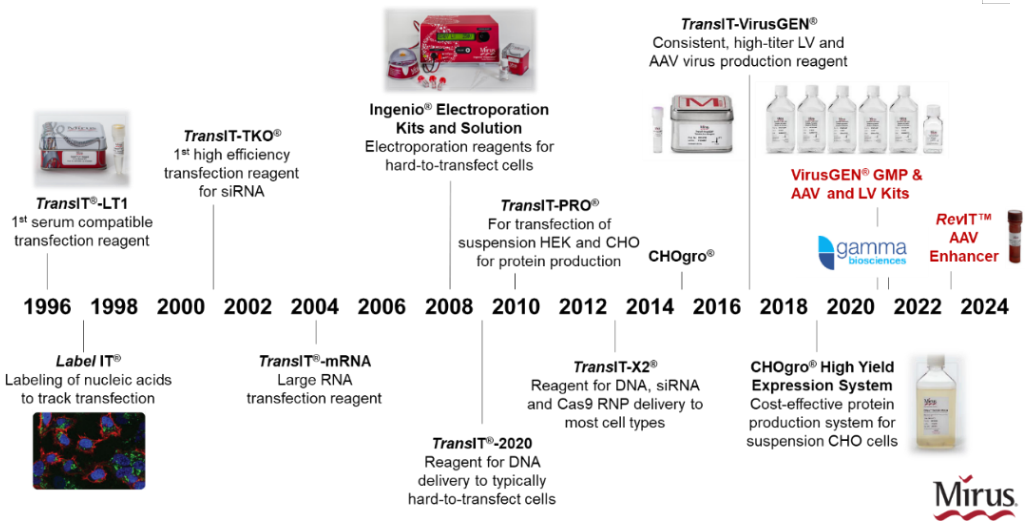
为什么 Mirus TransIT-X2® Dynamic Delivery System (请见访问链接:https://www.mirusbio.com/product/transit-x2-dynamic-delivery-system-0-3-ml-0-3-ml/ )有着如此高性能及广泛适应性呢?这归因于Mirus强大且高效的专利递转平台设计,可进行多重、多功能组合的转染试剂组分筛选并优化。成立于1995年的Mirus,专注及深耕核酸递转领域多年,从最早具有低毒性的TransIT ® -LT1到GMP级别、可用于AAV和LV生产的TransIT-VirusGEN®,都是基于该递转平台进行设计及开发。直至文稿发布时,使用Mirus产品发表文章已超过1万篇,并且发表文章及Mirus数据库涵盖了超过1千2百种细胞类型,更多文章及数据查询,请见访问链接:https://www.mirusbio.com/citation-search/。
图2、Mirus转染试剂原理示意图
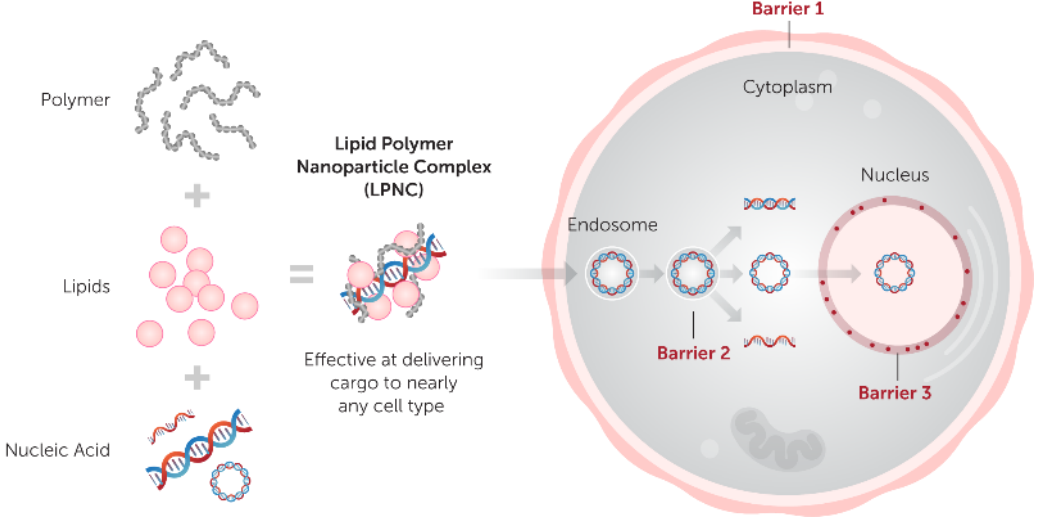
不同于传统基于单组分的转染试剂(如阳离子聚合物或阳离子脂质体),为了进一步提高转染效率,以应对不同细胞类型或特定的应用。Mirus将专利的多聚物(Polymer)及脂质(Lipids)技术进行多重组合,在不形成脂质体复合物(liposome,通常具有细胞毒性)前提条件下,得到多种类、高性能的转染方案,克服细胞递转过程中的多重阻碍,以实现更高效转染和更低的细胞毒性(图2)。
图3、Mirus独有智能迭代设计,转染试剂优化流程示意图
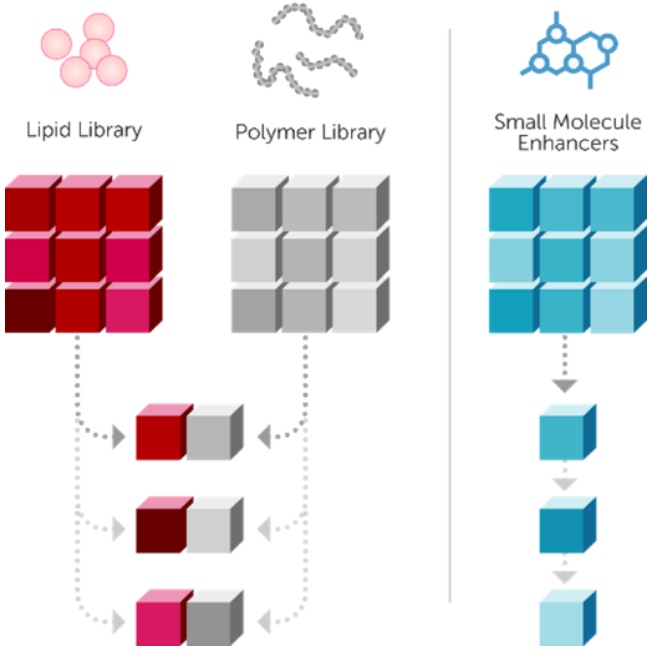
基于上述Mirus强大、高效的专利递转平台设计,在进行多重、多组合筛选、优化及后续验证。独有的智能迭代设计流程,优化转染技术中的每个组分。Mirus推出一系列经典转染试剂,以应对多种需求:
1、广谱、高性能、低毒性的转染试剂家族: TransIT-X2®、TransIT®-LT1、TransIT®-2020
2、针对特定细胞类型的转染试剂家族:TransIT®-293、TransIT®-BrCa、TransIT®-CHO、TransIT-HeLaMONSTER®、TransIT®-Insect、TransIT®-Jurkat、TransIT®-Keratinocyte
3、针对特定应用的转染试剂家族:
★.病毒生产:VirusGEN® 转染试剂及配套试剂盒、TransIT®-Lenti
★.蛋白/抗体生产:TransIT-PRO®、CHOgro® Expression System、CHOgro® High Yield Expression System
4、寡核苷酸递转的转染家族:TransIT®-Oligo、TransIT-siQUEST®、TransIT-TKO®
5、mRNA及长链RNA递转:TransIT®-mRNA
Mirus TransIT-X2® 转染试剂性能数据 展示图
4、TransIT-X2®Dynamic Delivery System在包括原代细胞多种细胞类型中,具有较高转染效率。
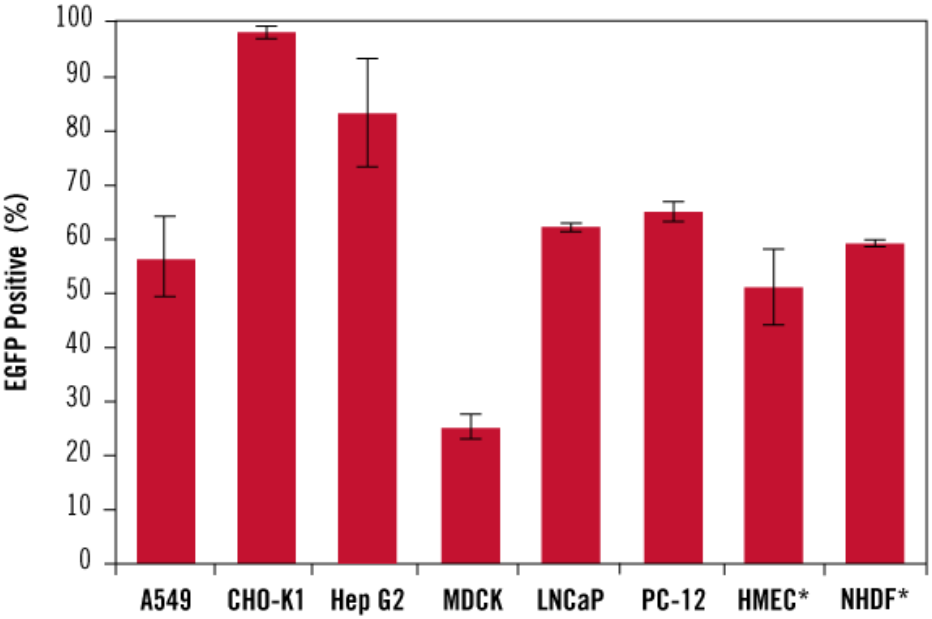
Mirus TransIT-X2®Dynamic Delivery System递转表达EGFP质粒DNA分别至A549、CHO-K1、Hep G2、MDCK、LNCaP、PC-12、原代人乳腺上皮细胞(HMEC)和正常人真皮成纤维细胞(NHDF)细胞中。实验使用96孔板, TransIT-X2®试剂加入量为0.2-0.4µl,DNA加入量为0.1µg(使用试剂:DNA=2:1、3:1或4:1)。转染后48小时,使用Guava® easyCyte™ 5HT流式细胞仪重复检测三次,评估转染效率。
图5、相较于使用单一组分且形成阳离子脂质体复合物(liposome)的Lipofectamine®系列转染试剂,TransIT-X2®有着更高的转染效率及更低细胞毒性
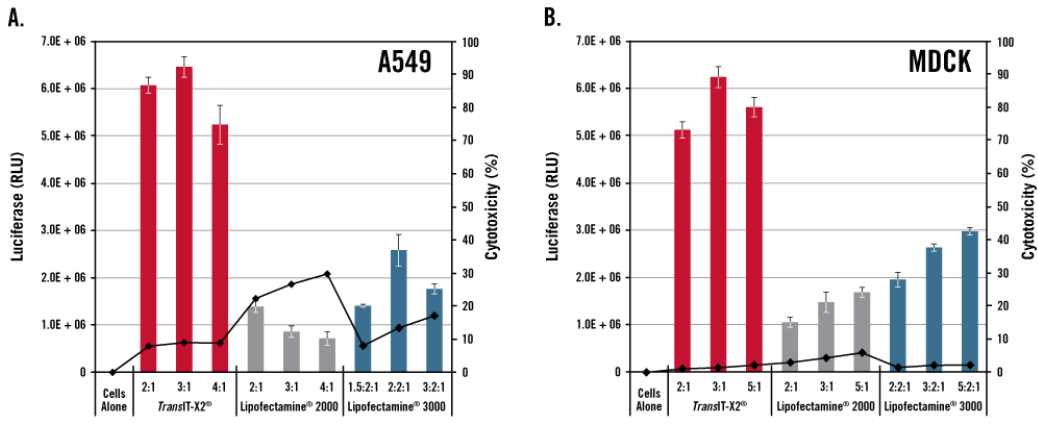
使用TransIT-X2®(Mirus Bio)、Lipofectamine®2000 (Thermo Fisher Scientific)或Lipofectamine®3000 (Thermo Fisher Scientific)转染荧光素酶编码质粒DNA至A549 (A)或MDCK (B)细胞中,转染24小时,通过荧光素酶活性评估转染效率,定量受损细胞中释放的LDH评估细胞毒性。与Lipofectamine®2000或Lipofectamine®3000的细胞相比,在最佳试剂:DNA比例下,Trans - x2®有着更高的荧光强度及更低的细胞毒性。
实验Tips: 针对更多特定细胞类型,试剂使用建议,详细请见:https://hub.mirusbio.com/m/d6a018920beec12e/original/Protocol-Optimization-Card.pdf
Mirus TransIT-X2® 在RNAi干扰实验中性能数据展示
图6、不同RNAi干扰途径示意图
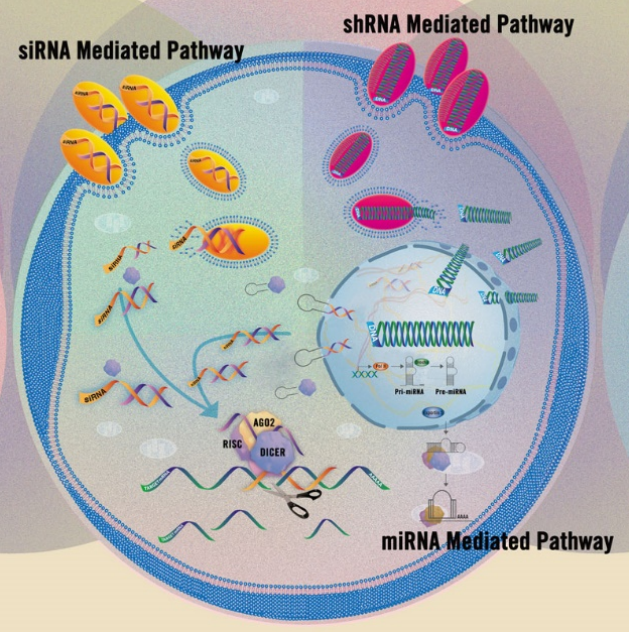
基因沉默相关功能研究在分子和细胞生物学中发挥着重要作用,化学转染也在该研究领域扮演者重要角色。常见参与RNAi干扰途径的天然RNA分子包括:
★.小干扰 RNA (Small interfering RNAs, siRNA) :由双链 RNA(dsRNA)断裂所产生的短双链 RNA(20-25bp);
★.微小 RNA(MicroRNAs, miRNAs) :非编码 RNA 处理后所产生的一类短的、单链 RNA(20-22nt)。
利用 RNAi 抑制基因表达的另一种方法为短发夹 RNA(short hairpin RNA , shRNA),这些短 RNA 序列可通过病毒或非病毒载体方式进行表达,更多详细信息可查阅Mirus Applications | RNAi Gene Silencing。
请见访问链接:https://www.mirusbio.com/applications-rnai-gene-silencing/
图7、基于siRNA核酸递转类型的基因沉默研究,相比Lipofectamine® 2000,TransIT-X2®有着更高的基因沉默效率
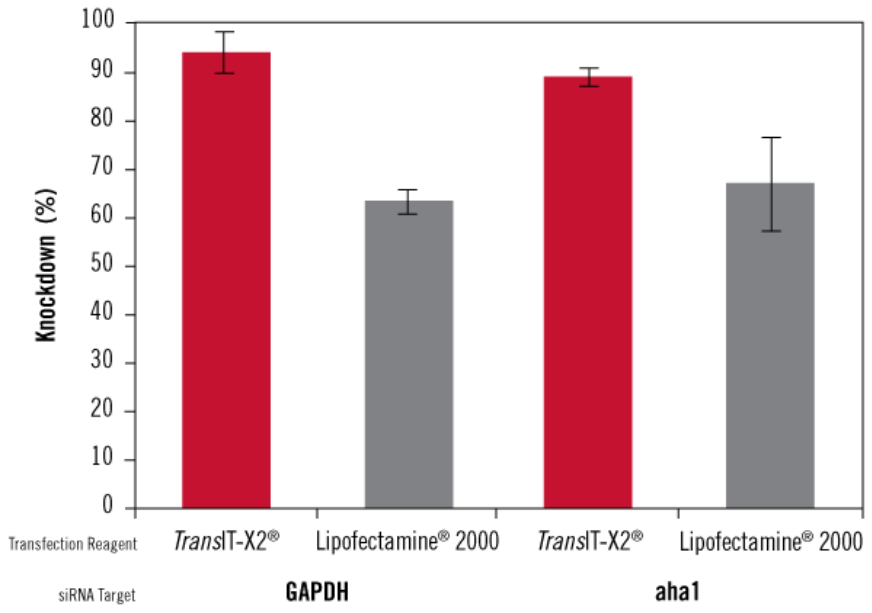
TransIT-X2®Dynamic Delivery System和Lipofectamine®2000转染试剂用于转染siRNA(靶点为内源性蛋白质- GAPDH和AHA1),对照使用正常人类真皮成纤维细胞(NHDF)递转非靶向siRNA。Trans IT-X2®加入量为4µl, Lipofectamine®2000加入量为6µl,siRNA加入量都为25 nM。使用qRT-PCR相对于18s rRNA水平测量GAPDH或AHA1 mRNA进行检测,转染后48小时均一化至非靶向对照组的mRNA水平,误差则为三次复孔实验的标准差。
图8、基于miRNA (miRNA Precursor及miRNA mimic)基因沉默研究,相比Lipofectamine® 2000,TransIT-X2®有着更高的基因沉默效率
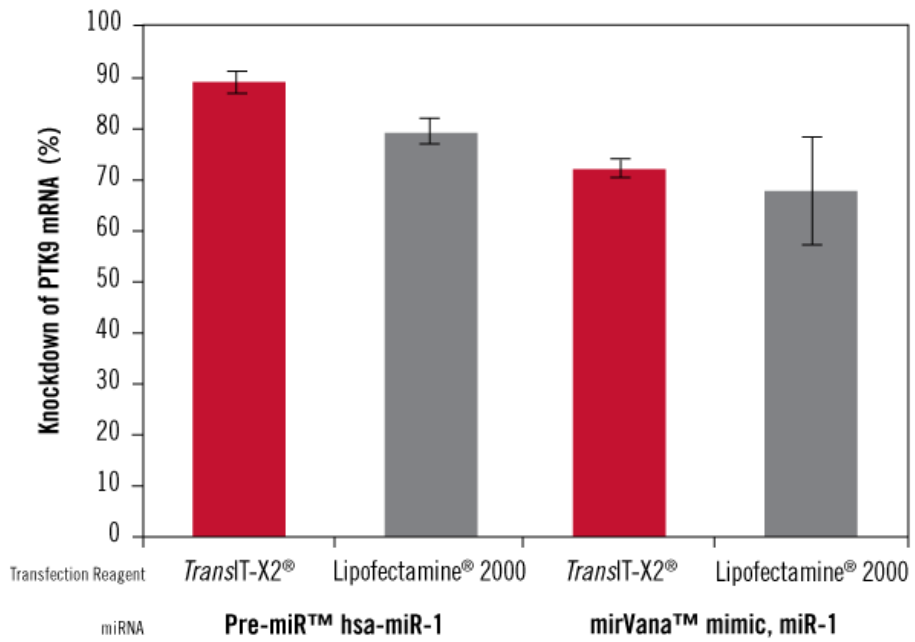
TransIT-X2®Dynamic Delivery System和Lipofectamine®2000转染试剂用于转染Pre-miR™ hsa-miR-1 miRNA Precursor 或者mirVana™ miRNA mimic, miR-1 (两者都已验证,可降低PTK9 mRNA表达水平)。Pre-miR™阴性质控用于评估mRNA表达水平基线值。Trans IT-X2®及Lipofectamine®2000试剂加入量都为3µl, 加入50 nM miRNA。使用qRT-PCR相对于18s rRNA水平,经过阴性质控的均一化,得到PTK9 mRNA表达水平值。
Mirus TransIT-X2® 在CRISPR基因编辑实验中性能数据展示
经过改造及优化的细菌 CRISPR/Cas9 系统,已被广泛应用到哺乳细胞的基因编辑中。基于CRISPR基因编辑实验常见两组分:Cas9蛋白及引导RNA(gRNA)。当Cas9蛋白切割了靶向基因组DNA,会触发两种内源性修复机制,即非同源末端连接(NHEJ)和同源定向修复(HDR),以应对细胞中产生的DNA断裂。基于NHEJ细胞修复通路,为非精准、且容易出错细胞修复通路,可引入导致基因功能缺失的Indel。基于HDR的细胞修复通路,则需要额外的同源 DNA 作为修复模板,从而实现“精准”修复,在目的基因插入特定的基因或长片段序列。
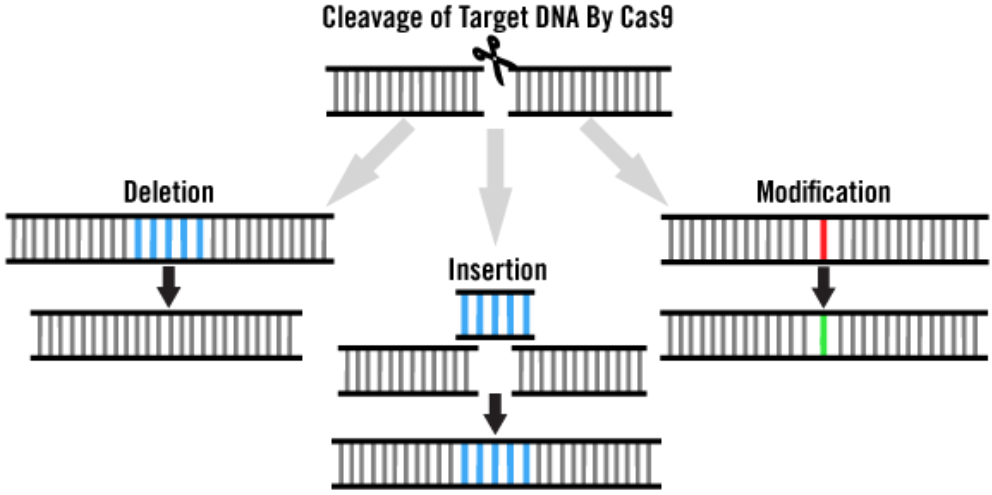
【 根据研究者们不同的实验需求 】
CRISPR基因编辑可以有多种类型实验设置,这意味需要面对不同核酸类型的转染甚至共转染,举例如下:
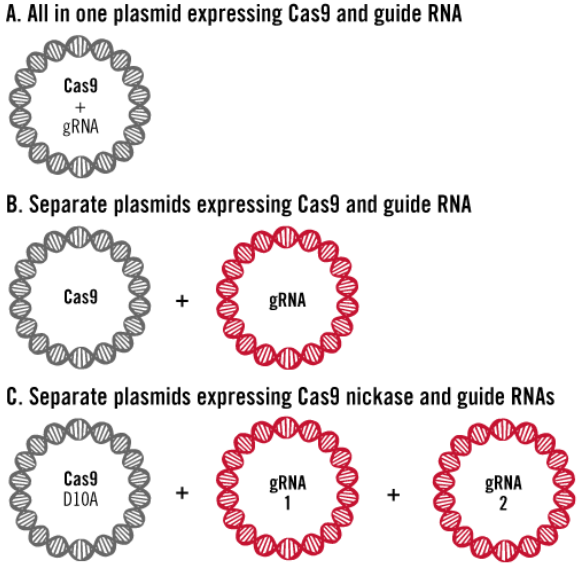
1、质粒pDNA转染
作为CRIPSR实验关键两组分:Cas9蛋白及gRNA,可以设计单个质粒DNA,共同表达两组分(A);或者使用两质粒系统,其中一个质粒表达Cas9蛋白,另外一个质粒表达gRNA(B);当使用Cas9切口酶(Nickase),则需要两条gRNA,这时可能需要三质粒系统的递转实验。
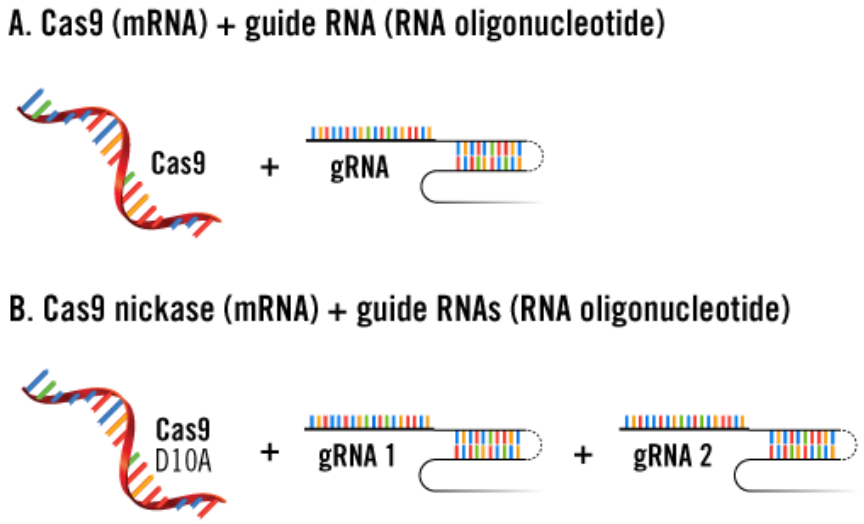
2、质粒DNA及RNA寡核苷酸共转染
此时,与上述实验设计不同的是,gRNA以寡核苷酸形式进行递转,这就意味着递转实验需要同时转染质粒DNA以及RNA寡核苷酸(A和B)。

3、mRNA及RNA寡核苷酸共转染
为了避免由于质粒DNA基因组整合而导致的脱靶效应,可以共转染编码Cas9蛋白的mRNA及gRNA (RNA寡核苷酸)。
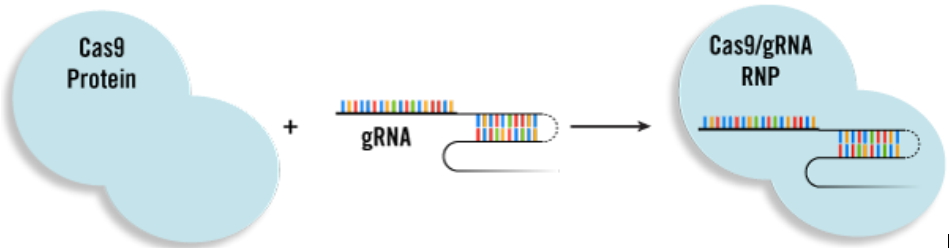
4、Cas9/gRNA RNP复合物递转
随着Cas9蛋白及gRNA商品化趋于成熟,越来越多的研究者们选择直接从第三方购买高保真Cas9蛋白,以及有着额外化学修饰且在细胞内更稳定的gRNA寡核苷酸。除了极大的缩短和简化CRISPR实验流程外,相对于质粒或者mRNA方式合成,直接递转RNP复合物的方式有着更高的特异性及编辑效率。
实验Tips: 针对上述不同CRISPR实验设计及递转情形,TransIT-X2® Dynamic Delivery System经优化的具体实验说明
下载链接如下:
图9、质粒DNA和gRNA寡核苷酸共转染:TransIT-X2®分别在293T/17、U2OS和NHDF细胞中共转Cas9质粒DNA与gRNA(RNA寡核苷酸),都有着较高的基因编辑效率(18-48%)
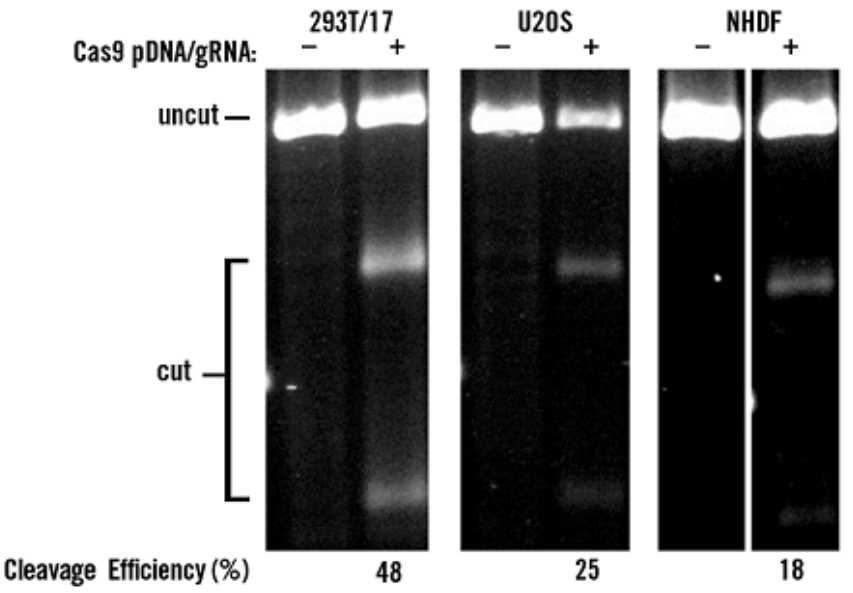
使用TransIT-X2® Dynamic Delivery System (2 µl/孔,24孔板, Mirus Bio)共转染0.5 µg质粒DNA(表达Cas9蛋白)及50nM 2-part gRNA (PPIB基因)至HEK293T/17, U2OS 及NHDF细胞中,转染后48小时,T7E1验证切割效率。
图10、Cas9/gRNA RNP复合体递转:相较于Lipofectamine®系列转染试剂,TransIT-X2®有着更高的切割效率
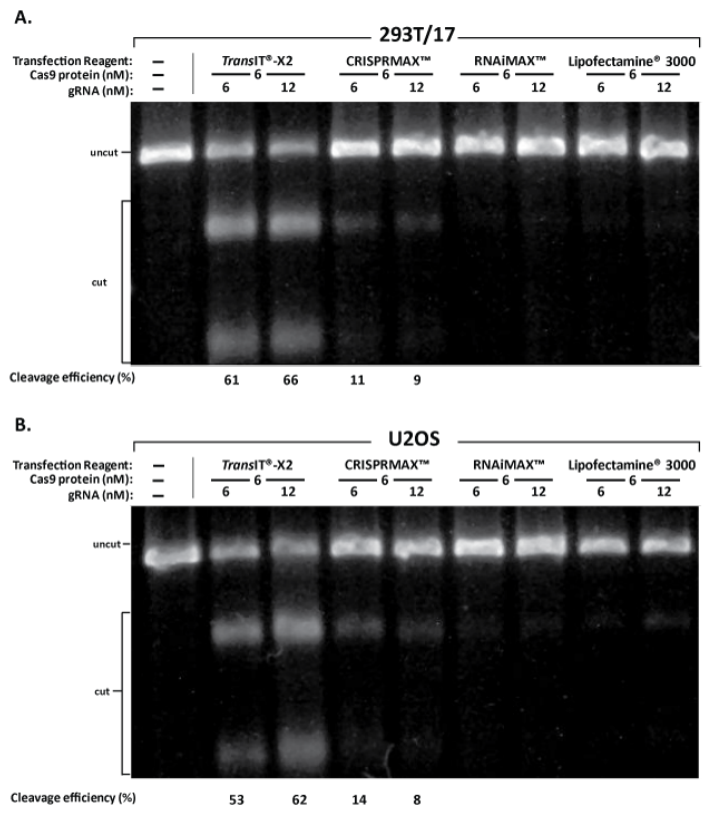
2-part gRNA (PPIB基因,IDT) 及Cas9 蛋白(PNA Bio)形成RNP复合体,分别使用TransIT-X2® Dynamic Delivery System(1 µl/孔, Mirus Bio)、Lipofectamine® CRISPRMAX™ (1.5 µl/孔, ThermoFisher) 、Lipofectamine® RNAiMAX (1.5 µl/孔, ThermoFisher) 、Lipofectamine® 3000 (1.5 µl/孔ThermoFisher) 递转至293T/17及U2OS细胞中。测试gRNA两种使用量(6 nM或12 nM),相同Cas9 蛋白加入量(6 nM),转染后48小时,T7E1验证切割效率。
Mirus TransIT-X2® 产品优势
☑、新型基于多组分开发的广谱型转染试剂(适用于多种细胞,包括难转细胞);
☑、可同时转染核酸及蛋白,包括不限于DNA,siRNA/miRNA和CRISPR/Cas9复合物;
☑、不形成脂质体复合物,降低细胞毒性;
☑、满足多种应用:基因过表达、基因沉默、基因编辑、干细胞研究、稳转细胞株构建等。
相关产品信息
|
产品名称 |
规格 |
货号 |
|
TransIT-X2® Dynamic Delivery System |
1×0.3ml |
MIR6003 |
|
1×0.75ml |
MIR6004 |
|
|
1×1.5ml |
MIR6000 |
|
|
5×1.5ml |
MIR6005 |
|
|
10×1.5ml |
MIR6006 |

更多详情请咨询Mirus全国授权一级代理-欣博盛生物
全国服务热线: 4006-800-892 邮箱: market@neobioscience.com
深圳: 0755-26755892 北京: 010-88594029
上海: 021-34613729 广州:020-87615159
代理品牌网站: www.neobioscience.com
自主品牌网站: www.neobioscience.net
