胶质母细胞瘤(Glioblastoma,GBM)是成人中常见的恶性脑肿瘤,其特征包括肿瘤坏死、微血管不稳定、抵抗常规治疗、复发率高等。肿瘤相关巨噬细胞(TAM)是胶质母细胞瘤中主要的免疫浸润细胞,直接与恶性细胞相互作用,促进肿瘤进展,在GBM中表现出显著的异质性,因此,TAM已成为一个有吸引力的治疗靶点。
目前在大规模的临床试验中还没有观察到显著有效的靶向TAM的方法,这可能源于肿瘤内和肿瘤间细胞多样性以及TAM池的可塑性。因此,探索TAM异质性和形成机制是设计靶向TAM肿瘤治疗的关键。近期,陆军军医大学第一附属医院全军临床病理学研究所卞修武院士/时雨副教授/平轶芳教授团队联合陆军军医大学第一附属医院脑胶质瘤医学研究中心/神经外科李飞副教授,华中科技大学武汉光电国家研究中心祁淑红副研究员在Cancer Cell上发表了题为“Identification of hypoxic macrophages in glioblastoma with therapeutic potential for vasculature normalization”的文章,该研究揭示了恶性胶质瘤内Mo-TAM的转录表型和空间分布异质性特征,鉴定出缺氧坏死微环境内富集的TAM缺氧亚群(Hypoxia-TAM)并证实其诱导微血管渗漏表型,阐明了靶向该亚群对胶质瘤血管正常化和提高抗肿瘤药物递送效率的治疗学意义。(麦特绘谱提供能量代谢和蛋白质组检测服务)

技术路线
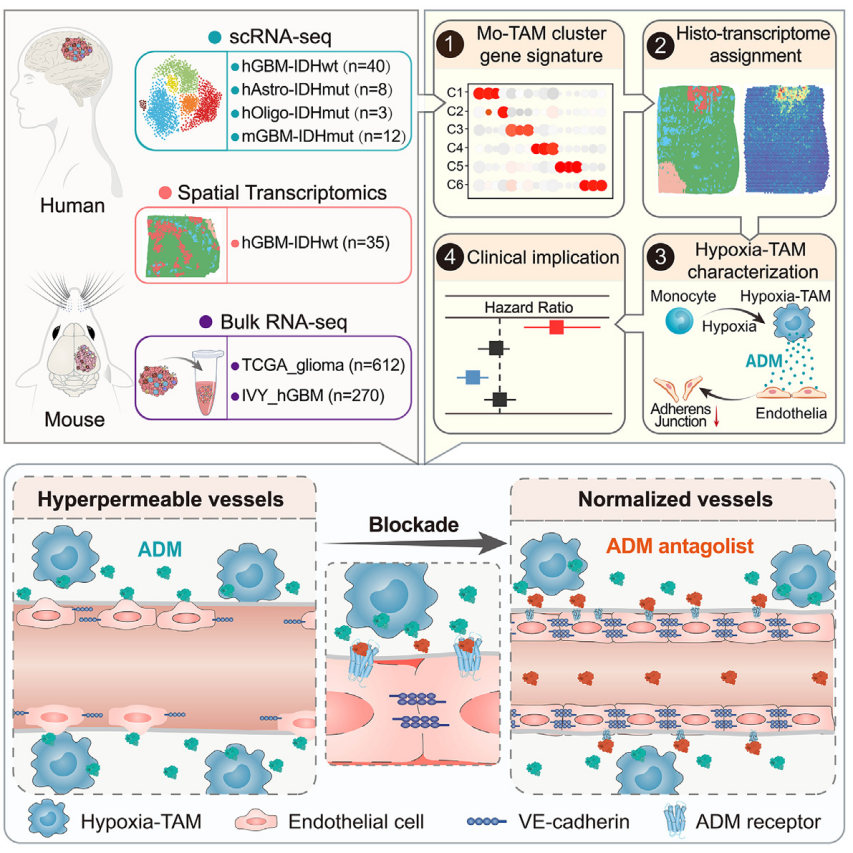
图1. 研究思路图
研究结果
1. 单细胞转录组学对51例人恶性胶质瘤Mo-TAM进行分析,聚类注释到具有缺氧响应、趋化运动、吞噬和抗原呈递、脂代谢依赖、干扰素产生、核糖体合成特征的新功能亚群,并证实Mo-TAM多个亚群的转录特征在小鼠胶质瘤和人实体肿瘤中具有高度保守性。
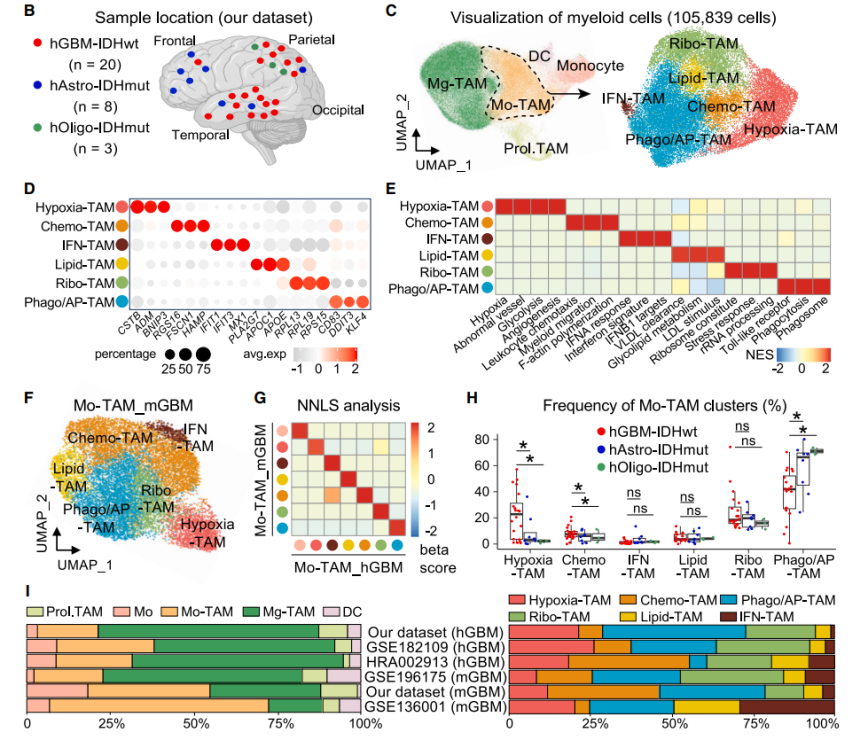
图2. Mo-TAM的单细胞转录组学景观
2. 空间转录组学揭示Mo-TAM的细胞多样性及异质性,分析了35例人恶性胶质瘤空间转录组数据,建立了Mo-TAM不同亚群转录组特征与胶质瘤组织病理结构的空间映射网络,绘制了Mo-TAM空间分布图谱,发现不同Mo-TAM亚群在血管富集区、缺氧坏死区和侵袭前沿区的分布差异。
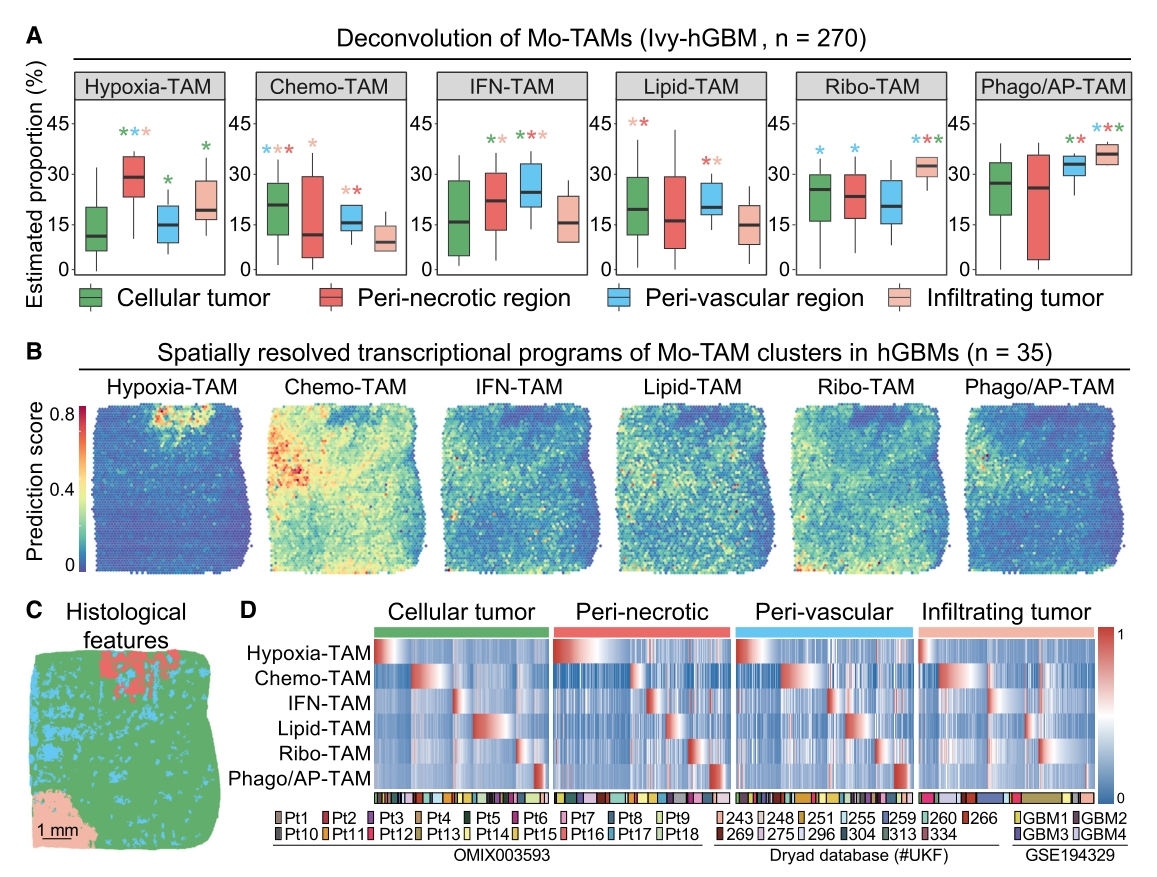
图3. 空间转录组学揭示Mo-TAM的细胞多样性特征
3. 多色免疫荧光成像证实了Hypoxia-TAM亚群在胶质瘤缺氧坏死区高度富集,发现空间缺氧梯度与Hypoxia-TAM表型转化、胶质瘤细胞间质型转化、糖酵解代谢重编程和微血管增生具有一定的相关性。
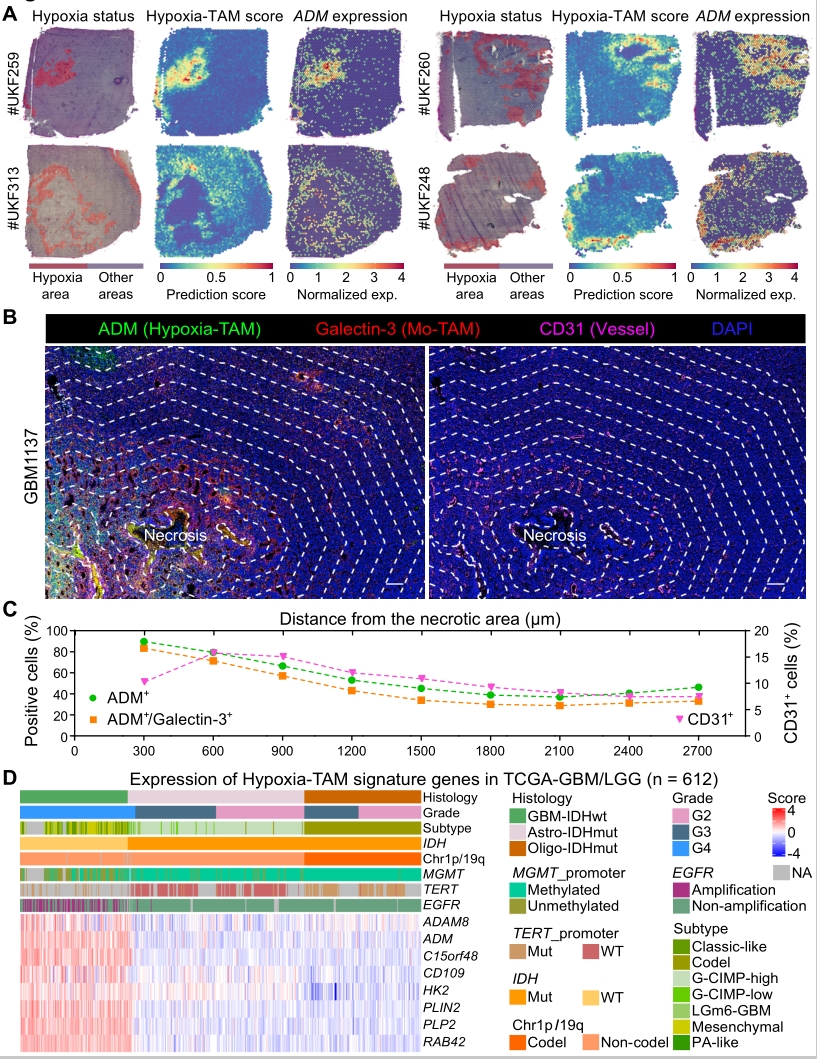
图4. Hypoxia-TAM亚群在缺氧坏死区高度富集
4. bulk(常规普通)转录组、蛋白质组和代谢组(能量代谢:糖酵解)的多组学整合分析,系统筛选并鉴定出缺氧坏死微环境内胶质瘤细胞产生的富含半胱氨酸的酸性分泌蛋白(secreted protein acidic and rich in cysteine,SPARC)和缺氧诱导产生的乳酸是Hypoxia-TAM亚群极化的关键因素,并表明两种因素协同诱导Mo-TAM内p50(由NFKB1编码)入核增强Hypoxia-TAM核心表型基因转录。
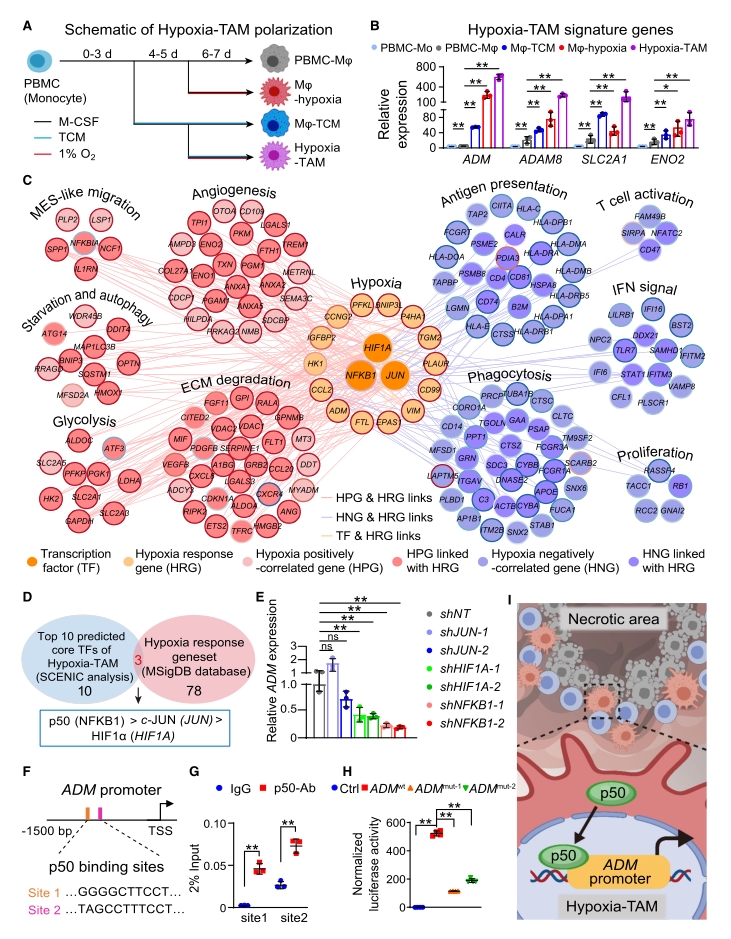
图5. 低氧诱导Hypoxia-TAM极化
5. 进一步研究表明,Hypoxia-TAM直接促进肿瘤血管的渗漏,并通过Hypoxia-TAM过度分泌肾上腺髓质素(ADM),致使胶质瘤内微血管内皮细胞间的黏附连接破坏,进而引发血管高渗漏和血流低灌注。敲除Ccr2-Cre转基因小鼠中单核细胞及其衍生细胞内Adm,或采用ADM拮抗剂阻断ADM分泌通路,能够选择性地恢复内皮连接完整性并减少血管渗漏,从而诱导肿瘤内微血管结构正常化。
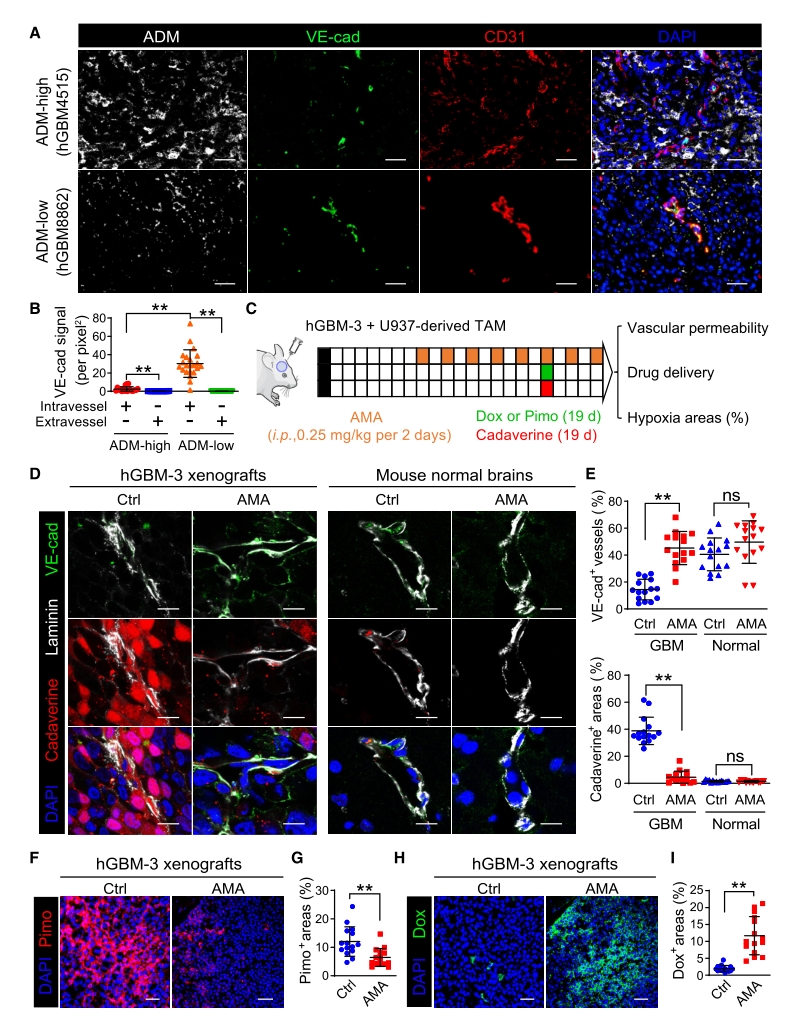
图6. AMA治疗hGBM异种移植瘤血管正常化
6. 构建Vehicle、Dab、AMA、AMA+Dab模型,在BRAFV600E突变型脑肿瘤中证实ADM拮抗剂(AMA)与BRAF小分子抑制剂达拉非尼(Dabrafenib)联用,能有效增加达拉非尼的瘤内灌注,促进胶质瘤血管正常化,抑制肿瘤生长。
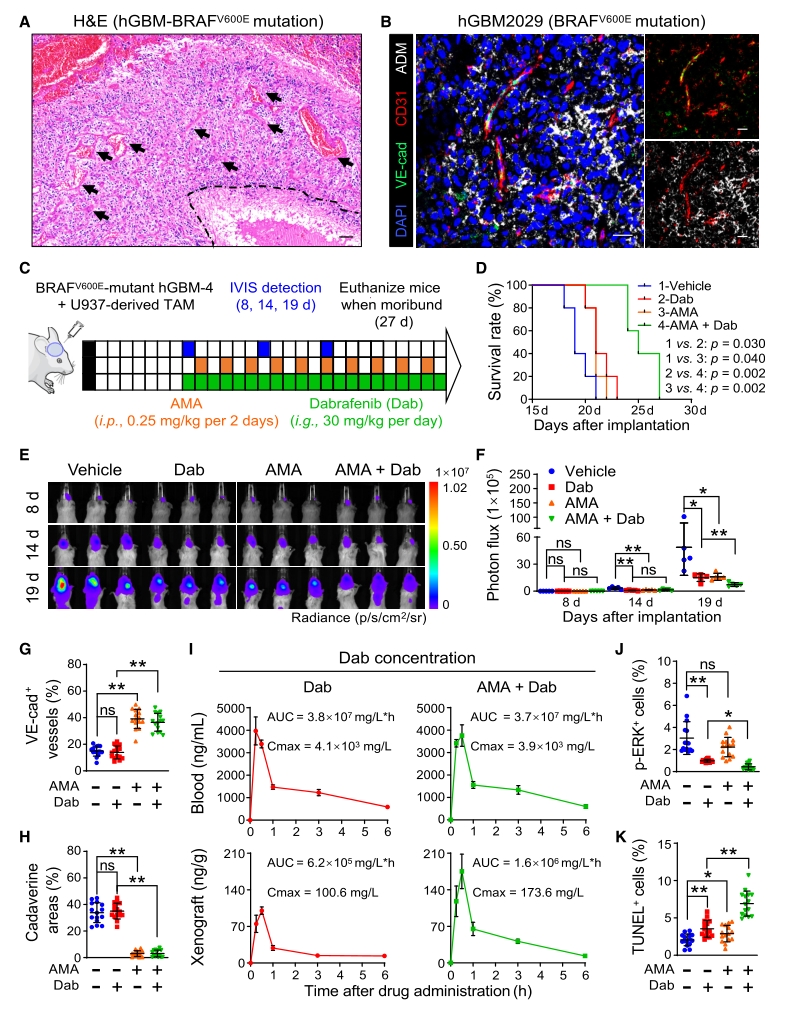
图7. AMA治疗改善达拉非尼的治疗效果
研究结论
该研究绘制胶质母细胞瘤TAM空间图谱,强调了脑胶质瘤中Mo-TAM的多样性和空间微环境引导的Mo-TAM重编程,鉴定出缺氧微环境内Hypoxia-TAM新功能亚群,指出了针对Hypoxia-TAM的潜在治疗方法,为提高肿瘤治疗药物灌注和疗效提供新策略。
参考文献
Wang W ,Li T ,Cheng Y , et al.Identification of hypoxic macrophages in glioblastoma with therapeutic potential for vasculature normalization.[J].Cancer cell, 2024.
请扫描二维码阅读原文

绘谱帮你测
麦特绘谱为本文提供能量代谢和蛋白质组检测服务,助力本研究发现富含半胱氨酸的酸性分泌蛋白和低氧诱导产生的乳酸,成为Hypoxia-TAM亚群极化的关键机制。麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱拥有Q1000,Q500、Q300、Q200和胆汁酸、短链脂肪酸、色氨酸及吲哚衍生物、多胺和TMAO类等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章400+篇,累计影响因子4000+,平均IF>10,包括Cell, Nature, Science, Cell Metabolism, Immunity, Gut, Hepatology, Microbiome等顶级期刊。
END
