百趣代谢组学资讯:4篇经典案例探索胆汁酸的代谢组学研究思路
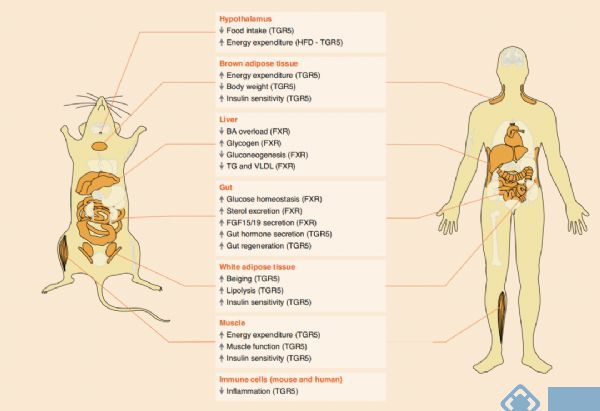
胆汁作为一种储存胆汁酸(BAs)的液体,已经被发现是调控健康和疾病的生化和分子基础。胆汁酸作为胆汁的主要成分(约占胆汁有机成分的50%),能通过肠道吸收脂质和脂溶性维生素到达身体几乎所有器官来调控机体代谢功能[1](图1)。
图1. BAs的靶组织和生物活性[1]
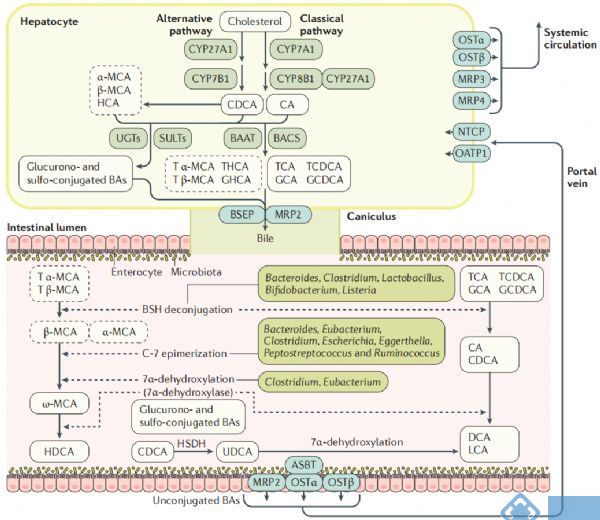
BAs是一种胆固醇代谢产物,主要作用于脂类代谢,最初由肝细胞中的胆固醇通过经典途径和替补途径在肝脏中酶的作用下合成初级胆汁酸(图2),其中胆酸CA和鹅脱氧胆酸CDCA可达总胆汁酸的90%;进入肠黏膜后,在肠道细菌(如拟杆菌、梭状芽孢杆菌、乳酸菌和梭杆菌等)的作用下发生去结合、去羟基和氧化还原等反应,产生不同的次级胆汁酸(如脱氧胆酸DCA,石胆酸LCA和熊去氧胆酸UDCA等);在回肠末端,95%的次级胆汁酸被重吸收进入肠细胞并通过基底外侧BA转运蛋白进入门脉循环,然后被吸收到肝细胞中重新形成初级胆汁酸并分泌入胆汁,从而完成一次“肝肠循环”(enterohepatic circulation),人体胆汁酸每天循环6~10次,从而保证机体的正常运行[1,2]。
图2. 胆汁酸的合成、运输和代谢[2]
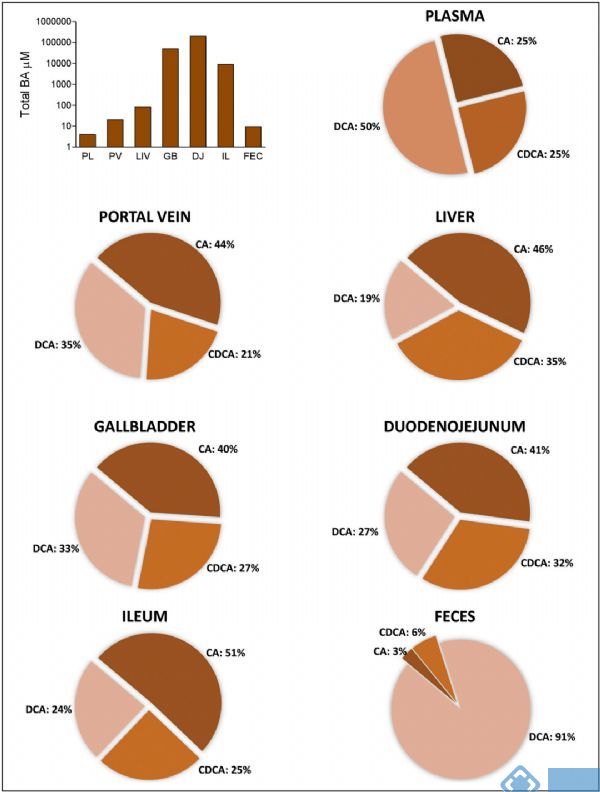
胆汁酸的在人体内不同部位含量不同(图3),其合成、分泌、重吸收及加工转化等均与肝、胆和肠等密切相关。同时,肠道微生物也影响宿主胆汁酸库组成。小鼠实验的研究中发现,胆汁酸组成和浓度直接受到肠道菌群及其宿主来源的初级胆汁酸代谢组学的影响,常规小鼠的胆汁酸在化学结构上比无菌鼠更加多样化,胆汁酸最多样化区域是盲肠、结肠和粪便等微生物密集而多样化的生物区域,中断肠道微生物群落导致胆汁酸代谢紊乱[3]。
图3. 人体内不同器官胆汁酸组成[4] (PL:血浆, PV:门静脉, LIV:肝脏,
GB:胆囊, DJ: 十二指肠和空肠, IL: 回肠, FEC: 粪便)
最近,随着各种代谢组学技术的发展以及“肠道微生物-胆汁酸-疾病轴”的研究不断被挖掘,胆汁酸被发现与肝脏相关疾病[5]、肠道相关疾病[6,7]、糖尿病[8]、机体炎症[9]、阿尔兹海默症[10]、新生儿发育[11]等的发生发展密切相关。接下来从几个不同层面的研究,分享胆汁酸与疾病研究的几个案例,希望能给大家提供一些思路。
01与疾病关系研究
研究内容:基于代谢组学技术发现与多发性硬化(Multiple Sclerosis, MS)相关的胆汁酸[12] IF=14.808
发表时间:2020年
发表期刊:Journal of Clinical Investigation
样本类型:血浆,细胞
研究对象:发现集包含159例成人(56例复发缓解型多发性硬化RRMS, 51例进展型硬化和52例健康对照) + 验证集包含250例成人(175 例MS和75例健康对照)+ 62例MS儿童,小鼠。
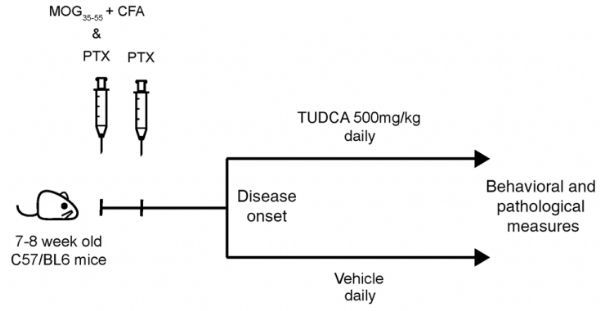
研究小结:本研究首先通过非靶代谢组学发现与多化性硬化的发生发展相关的胆汁酸;然后再用新的队列对胆汁酸进行靶标定量,验证了次级胆汁酸和初级胆汁酸在MS发展中的变化;同时在儿童多发性硬化数据集的非靶代谢组学数据中也发现了初级胆汁酸的变化,DCA/CA也在疾病组中升高。接下来又分别进行细胞实验,发现胆汁酸受体在MS的免疫和神经胶质细胞中表达增强,表明胆汁酸在调控神经性炎症中的作用。最后,分别再对细胞和小鼠补充牛磺熊去氧胆酸TUDCA,进一步验证TUDCA通过调控胆汁酸受体GPBAR1缓解MS。
02潜在生物标志物研究
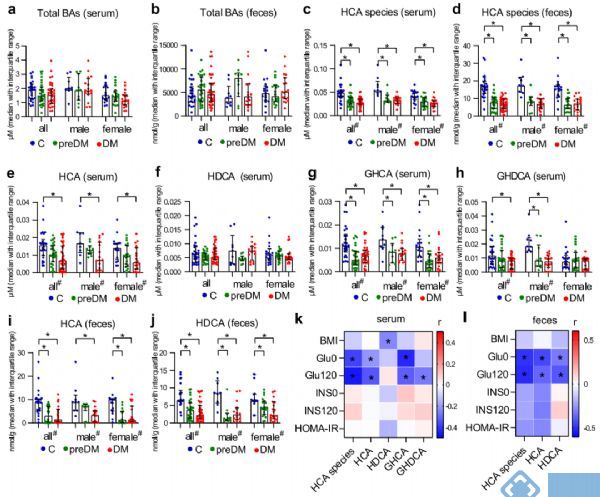
研究内容:基于多中心大规模人群胆汁酸技术平台,发现与代谢紊乱相关的潜在生物标志物[13]IF=14.919
发表时间:2021年
发表期刊:Nature Communications
样本类型:血清和粪便
研究对象:5个中心的1500+人群
研究小结:本研究首先采用1个横截面队列,对1107名研究对象(585名健康人,419名超重肥胖者,103名超重肥胖合并糖尿病患者)进行研究,发现血清HCAs在肥胖和糖尿病人中降低;之后再分别用新的横截面队列(26名血糖正常人,30名糖尿病前期和35名新发糖尿病且未用药患者)的血清和粪便、胃旁路手术干预后不同时间点(38个手术前,手术后1个月、3个月、6个月和12个月,26人2年)的血清进行研究,不仅验证了前期发现的结果,也进一步发现HCAs具有预测代谢手术恢复情况的能力;最后又选取2个队列(上海132人十年随访,北京207人五年随访),进一步将跟踪人群分为代谢异常和代谢正常人群进行分析,表明总HCA与单个不同种HCA的稳定性和对代谢异常有强的预测能力,从而表明HCAs作为未来代谢组学异常发展的生物标志物的可行性。
03机制探索
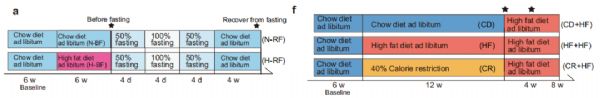
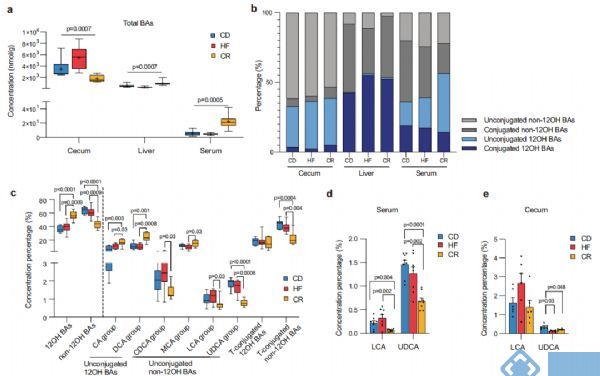
研究内容:基于宏基因组和代谢组学技术探讨热量限制饮食后体重反弹的机制[14]IF = 14.919
发表时间:2022年
发表期刊:Nature Communications
样本类型:肠道内容物,肝脏和血清
研究对象:小鼠(4~9只/组)
研究小结:本研究选取C57BL/6J小鼠为研究对象,发现常规饮食后再禁食小鼠体重和肝指数反弹。为考察禁食是否引起微生物的变化,又建立不同饮食干预(常规饮食CD, 高脂饮食HFD和禁食CR)后高脂饮食模型,并对盲肠内容物进行宏基因检测,发现CR和HFD均能重塑肠道微生物群,其中副拟杆菌(狄氏副拟杆菌,Parabacteroid distasonis)、7α-HSDH通路和BSH通路在CR和HFD后显著下降,血清和盲肠中胆汁酸检测结果表明CR组中石胆酸LCA和熊脱氧胆酸UDCA等非12α-羟基化胆汁酸(non-12OH BAs)含量降低;对肝脏样本代谢胆汁酸酶的基因检测发现,CYP7A1在CR组中含量较高,与non-12OH
BAs合成相关的酶CYP7B1显著降低。最后,又建立模型给小鼠补充P.distasonis和non-12OH BAs以及基因敲除小鼠模型,进一步验证限制饮食后体重反弹可能取决于P.distasonis和non-12OH Bas的相互作用。
04疾病治疗
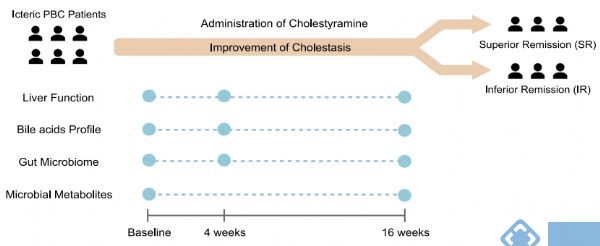
研究内容:基于宏基因组和代谢组学技术研究消胆胺对原发性胆汁性胆管炎(Primary Biliary Cholangitis,PBCs)的治疗作用[15]IF = 10.245
发表时间:2021年
发表期刊:Gut Microbes
样本类型:血清和粪便
研究对象:33名PBC患者
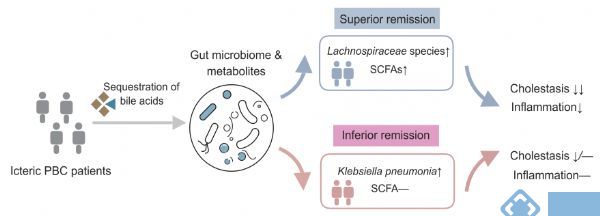
研究小结:本研究选取33名PBCs患者进行消胆胺治疗,分别采集基线、治疗后4周和16周的血清和粪便样本进行胆汁酸代谢组学检测和宏基因组检测。对胆汁酸数据分析发现,血清和粪便样本中总胆汁酸水平在消胆胺治疗后显著降低,粪便样本中脱氧胆酸(DCA)和石胆酸(LCA)在粪便样本中升高,同时对根据治疗16周后总胆汁酸水平变化情况将受试者分为SR组(superior remission of cholestasis,缓解显著组,大于中位值)和IR组(inferior remission,缓解不显著组,小于中位值)的胆汁酸数据分析发现胆汁酸降低更明显。宏基因组学数据分析发现产短酸的毛螺菌科的增加和触发自身免疫功能的罗氏弧菌的降低;对血清短链脂肪酸的分析发现短链脂肪酸的增加最后,对胆汁酸、菌群相关代谢物和炎症因子的关联分析发现,SR组有更多的关联,而IR组中较少。
基于以上文章我们可以发现,通过代谢组学分析(如非靶代谢组学、高通量靶向代谢组学和广泛靶标代谢组学等)可以得到与疾病相关的代谢物变化(如胆汁酸,氨基酸,短链脂肪酸和色氨酸等),并可通过进一步扩大样本量进行靶标验证代谢物在疾病中的含量变化,为筛选临床疾病预防-预警-诊断-预后相关生物标志物提供更多数据支持;此外,通过宏基因组学研究发现与疾病相关的微生物含量或者功能的变化,将微生物与代谢物进行联合分析解析相关临床生物学问题,深入探究疾病发生发展机制;最后还可以通过如粪菌移植或单一菌株或代谢物干预进行体内外细胞和动物功能验证,为临床疾病治疗提供数据依据。
参考文献:
文/阿趣代谢组学