大量肠道菌群队列研究表明肠道微生物与宿主的健康与疾病状态存在潜在的因果关系,已有充分证据证实肠道共生菌能够通过脱羟基化作用将初级胆汁酸转化为次级胆汁酸DCA和LCA,但更多的次级代谢产物尚未被发现,而这些代谢物在疾病及健康状态下的功能也有待研究。
2024年1月,微生物技术国家重点实验室刘双江教授团队与合作单位团队在Nature Microbiology上发表了题为“Gut commensal Christensenella minuta modulates host metabolism via acylated secondary bile acids”的研究论文,揭示C. minuta等肠道共生菌通过产生新型次级胆汁酸——3-O-酰基胆酸,从而靶向肠肝信号轴调控宿主糖脂代谢的新机制,并证明小克里斯滕森氏菌Christensenella minuta及酰基胆酸具有治疗II型糖尿病等慢性代谢类疾病的应用潜力。(麦特绘谱提供Q300全定量代谢组检测服务)

研究思路

DIO:高脂饮食诱导的肥胖模型;FXR:法尼醇X受体
研究结果
1. 新型次级胆汁酸的发现
首先,作者收集了7个公开的代谢性疾病(T2D、肥胖、NAFLD和CVD)肠道宏基因组数据集,通过与健康人群的数据进行比较,筛选出175个在代谢疾病队列中丰度显著下调的肠道菌群,其中88种占主导地位,且可培养。随后利用这些肠道菌群对胆汁酸进行了基于培养的体外转化实验,并通过LC-MS分析表征了胆汁酸的转化谱,结果发现了以C. minuta(Christensenella minuta)为代表的多个菌种代谢产生的4种新的胆酸衍生物,其m/z分别为449.3、463.3、477.3和491.3。
通过胆汁酸的特征二级碎片比对,发现这些胆汁酸衍生物分别含有乙酰、丙酰、丁酰和戊酰基团。核磁共振谱解析结果证实,上述衍生物为3-乙酰胆酸(Ac-CA)、3-丙酰胆酸(Prp-CA)、3-丁酰胆酸(Buty-CA)和3-戊酰胆酸(Val-CA)。以上结果表明, C. minuta可通过对胆汁酸的3′-羟基末端进行特异性酰基化修饰,从而得到一系列新的次级胆汁酸。
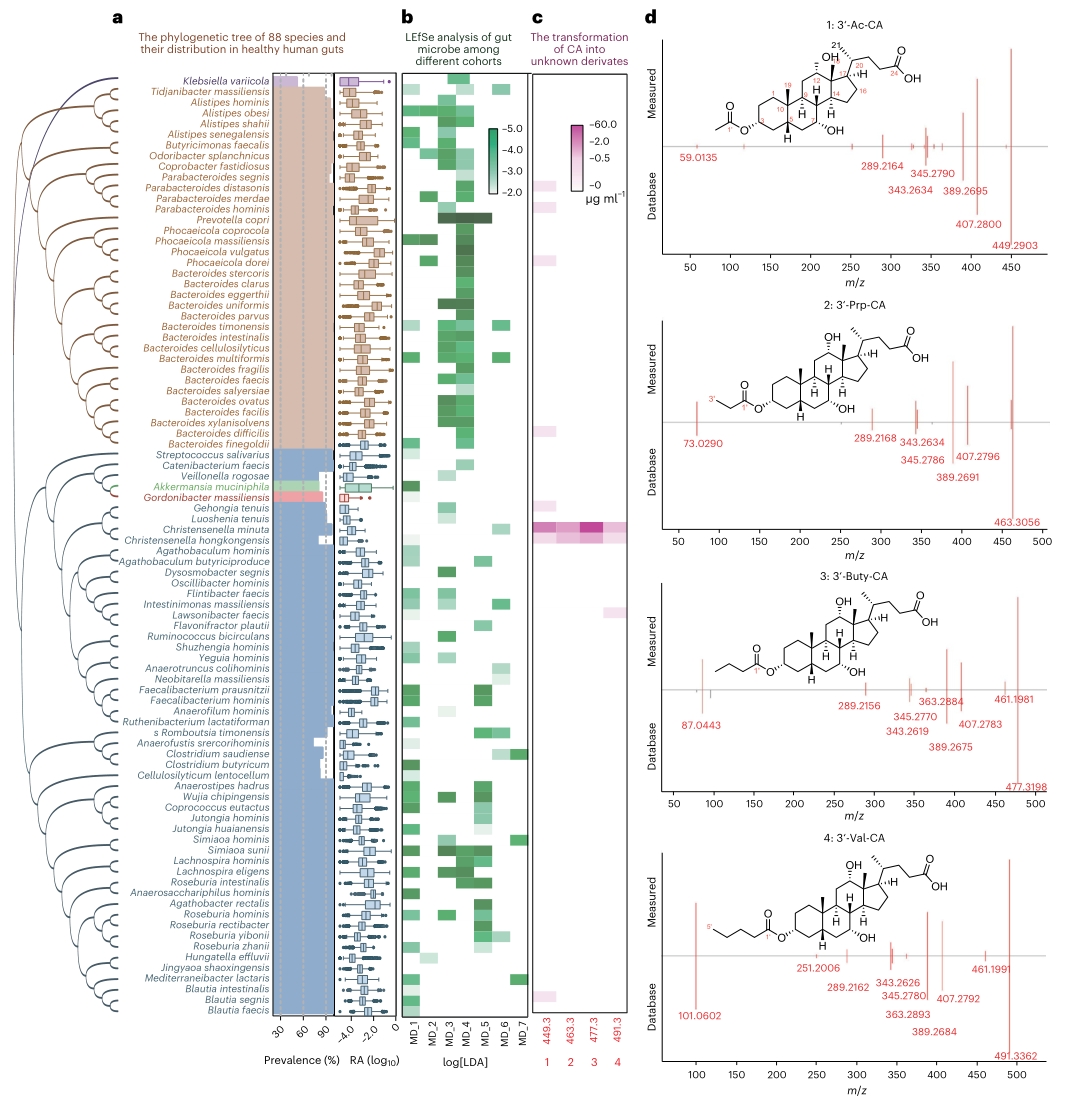
图1. 肠道微生物介导的胆汁酸转化为新型的3-O-酰基胆酸
2. C. minuta可减轻肥胖小鼠的代谢紊乱
为了评估C. minuta及3-O-酰基胆酸的生理功能,作者对高脂饮食诱导的肥胖(DIO)小鼠进行了C. minuta灌胃试验。多项生理病理指标表明,C. minuta治疗后的DIO小鼠病理性高血糖和脂代谢紊乱得到显著缓解,肝内和结肠炎症也有所降低。此外,盲肠内容物的16S rRNA测序证实C. minuta灌胃对DIO小鼠肠道菌群的α及β多样性没有显著影响,而Prp-CA、Buty-CA、Val-CA和3-O-酰基胆酸总浓度在小鼠回肠中显著增加。
以上结果表明,C. minuta产生的3-O-酰基胆酸水平与DIO小鼠的代谢特征改善之间存在正向关系。
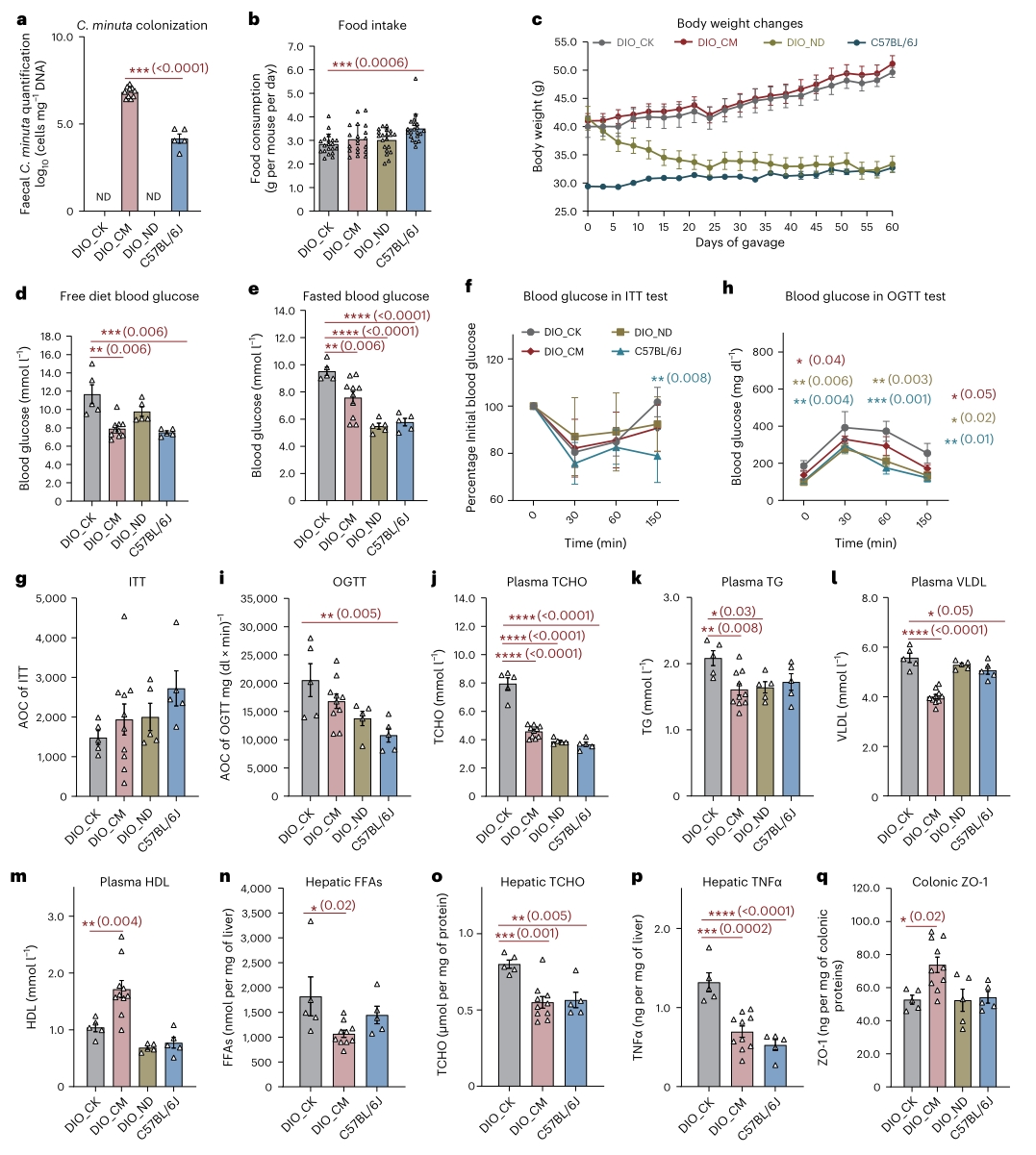
图2. C. minuta对DIO小鼠代谢的影响
3. 3-O-酰基胆酸是法尼醇X受体的拮抗剂
在检测肠道中与胆汁酸相关的基因的表达时,作者发现C. minuta组中受法尼醇X受体(FXR)调控的Fgf15基因被显著抑制,而代谢组分析却显示先前已知的FXR拮抗胆汁酸,如牛磺熊去氧胆酸和牛磺β鼠胆酸(TUDCA和TβMCA)均未显著增加。因此推测由C. minuta生成的3-O-酰基胆酸可能是靶向FXR的信号分子,并通过双荧光素酶报告实验进行测试。结果表明,3-O-酰基胆酸抑制了CDCA诱导的FXR活化,且这种抑制作用存在剂量效应,具体而言:Ac-CA和Buty-CA测定的半数最大抑制浓度(IC50)分别为49.73和33.60μM。
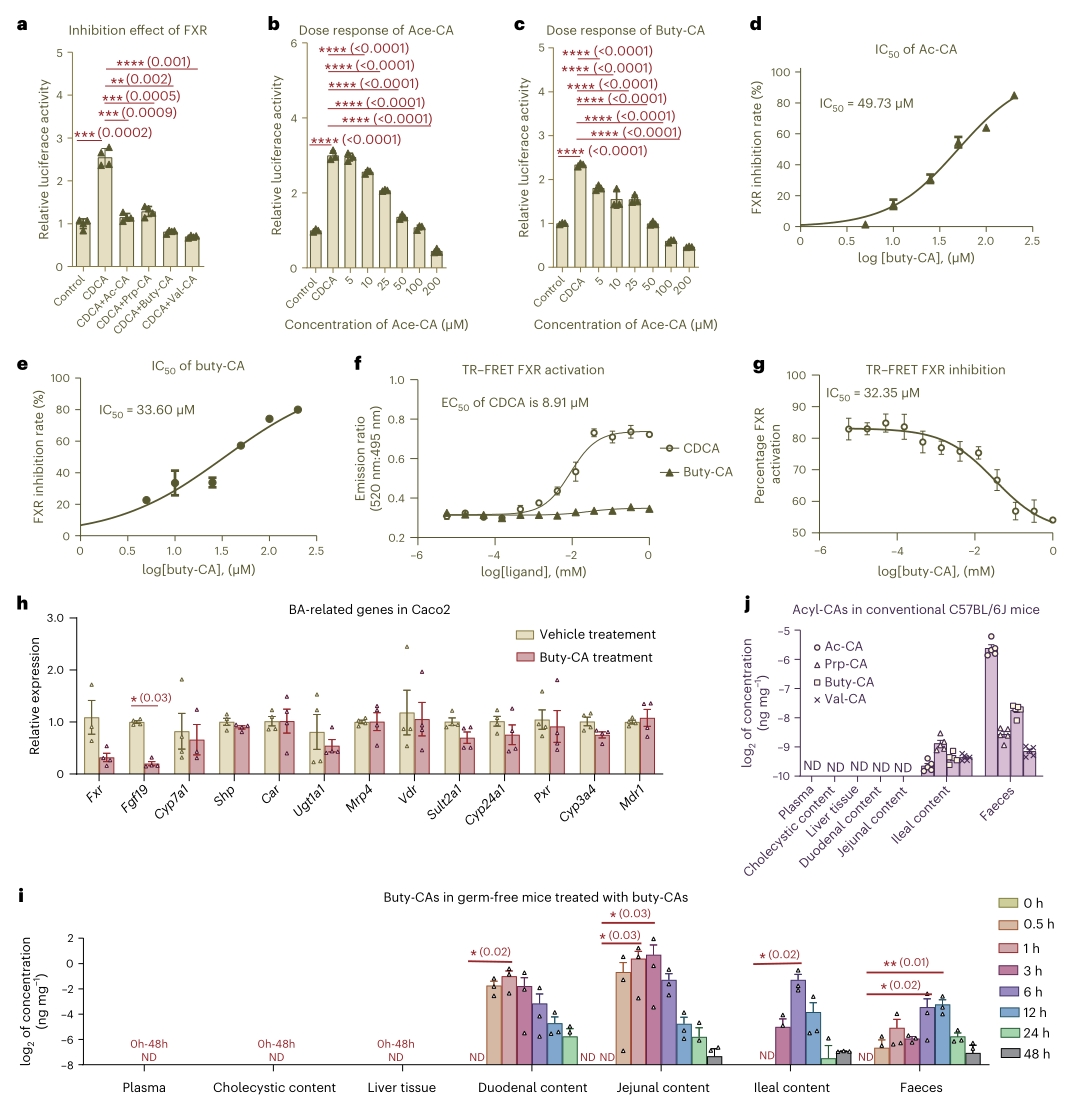
图3. 3-O-酰基胆酸的细胞培养基于生理功能的鉴定和基于小鼠的药代动力学
4. C. minuta靶向调控FXR-肠肝信号轴
接下来作者进一步分析C. minuta灌胃是否会对肠道FXR-肠肝信号轴进行调控。在动物中存在两个经典肠道FXR信号轴:调节胆汁酸和胆固醇的代谢FXR-FGF15-Cyp7a1通路、以及影响肝葡萄糖异生、脂肪变性、动脉粥样硬化和胰岛素抵抗的FXR-Smpd3-鞘氨醇轴。通过检测相关的基因表达和代谢标志物水平,发现小鼠肠道中这两条通路均受到C. minuta处理的改变,具体而言:
对于FXR-FGF15-Cyp7a1轴而言,检测到回肠中Fgf15下调表达,肝组织中Cyp7a1的浓度显著增加。总体而言C. minuta对FXR-FGF15-Cyp7a1轴的调节有助于总胆汁酸的增加,这一结果也解释了C. minuta处理后小鼠血液和肝脏中总胆固醇降低以及次级胆汁酸增加等现象。
对于FXR-Smpd3-ceramide轴而言,C. minuta处理的DIO小鼠中,编码鞘磷脂磷酸二酯酶3的Smpd3水平以及血浆和回肠内容中C16:0 ceramide的浓度显著降低,显示该信号通路被抑制,而这可能进一步抑制肝脏的糖异生,从而解释C. minuta处理缓解DIO小鼠的高血糖和肝病变现象。
以上结果揭示了由C. minuta衍生出的“3-O-acylated CA-intestinal FXR”肠-肝信号轴,并推测了C. minuta在DIO小鼠中通过该信号轴的调控机制。
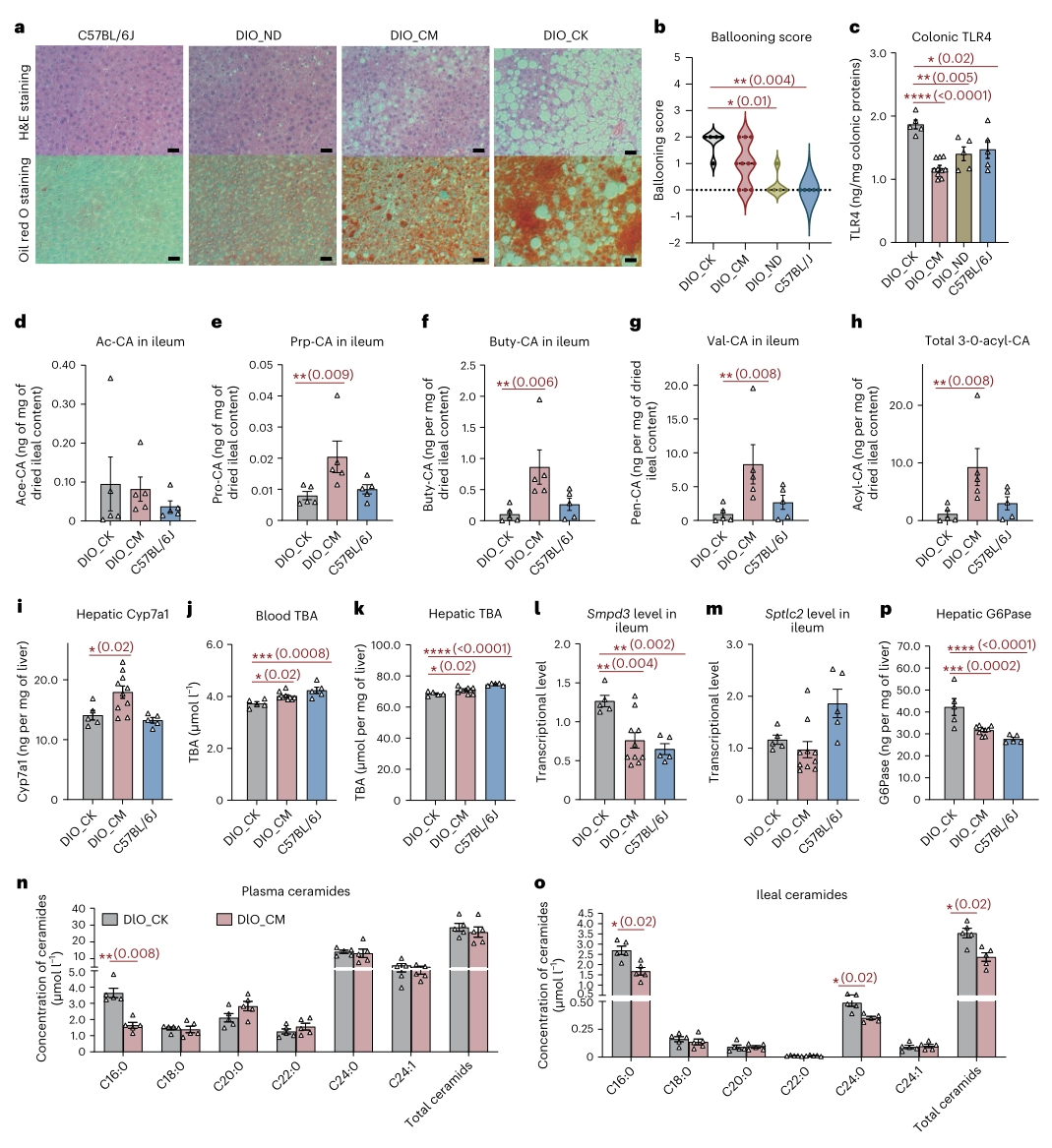
图4. C. minuta对DIO小鼠FXR肠-肝信号通路的影响
5. C. minuta的疗效依赖于肠上皮的FXR
为验证C. minuta、3-O-酰基胆酸和肠道FXR信号之间确实存在联系,作者通过构建肠道FXR特异性敲除的小鼠模型重复了高脂饮食(HFD)和C. minuta 灌胃试验。结果表明,野生型对照小鼠在C. minuta的处理下并未出现因HFD而引起的肥胖、高血糖、血脂紊乱和肝损伤,而敲除小鼠的表型与对照小鼠相反,说明C. minuta并未产生相应的疗效。此外,野生对照小鼠在经过C. minuta处理后,其肠-肝FXR信号通路发生了与上文DIO灌胃小鼠相同的变化。以上结果表明,肝-肠FXR信号通路确实是C. minuta对宿主代谢起到疗效的关键靶点。
此外作者还探究了C. minuta对3-酰基化修饰是否具有底物特异性,通过不同胆汁酸(CA、CDCA、UDCA、DCA、LCA、GCA、TCA、TCDCA和GCDCA)的体外转化实验,发现除LCA和UDCA外,C. minuta对其余检测的胆汁酸都显示出酰化活性,但催化活性存在差异,比如对牛磺胆酸盐(TCA和TCDCA)和DCA的催化活性较弱,而对甘氨酸胆酸盐、CA和CDCA较强。
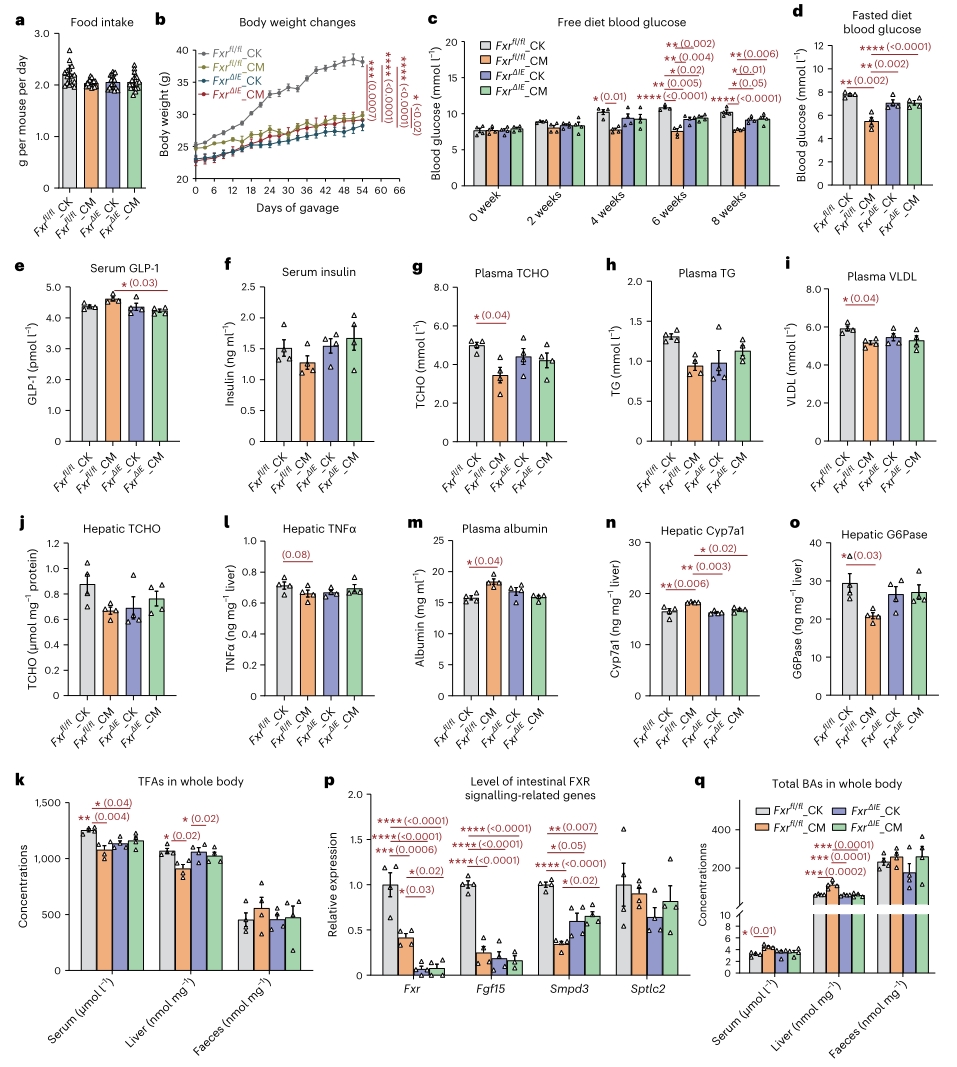
图5. C. minuta对高脂饮食诱导的肠FXR敲除小鼠和野生对照小鼠的影响
6. 3-O-酰基胆酸在II型糖尿病人群中显著降低
最后作者着眼于临床转化,探究3-O-酰基胆酸是否在人群中与代谢紊乱呈负相关。为此作者招募了46名志愿者,包括28名II型糖尿病患者和18名健康对照者,并收集其粪便样本进行3-O-酰基胆酸检测。结果表明,II型糖尿病队列的粪便3-O-酰基胆酸含量显著降低,平均浓度较健康队列中的低1.4到3.7倍。表明在代谢紊乱的临床队列人群中,除了C. minuta等有益肠道共生菌群丰度降低外,酰化胆酸等具有代谢调控作用的功能化合物也显著减少。
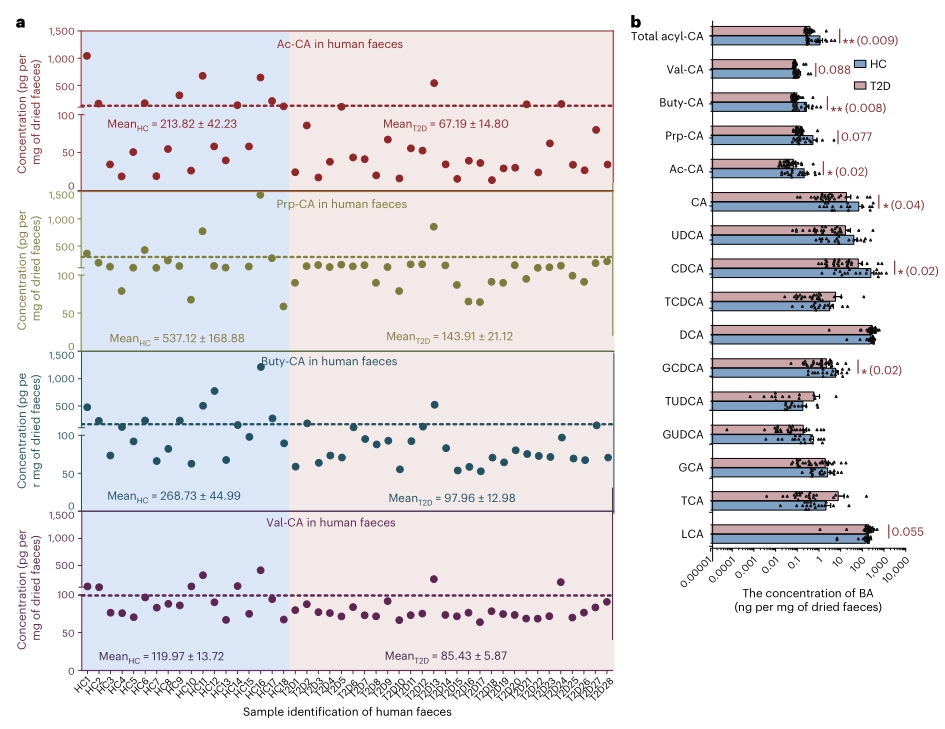
图6. 4种3-O-酰基胆酸和12种常见胆汁酸在II型糖尿病队列的分布和浓度
研究结论
本研究发现了一种以3-O酰基化为特征的新型次级胆汁酸,它是肠道FXR的天然拮抗剂,并解释了以C. minuta为代表的肠道益生菌通过 “肠道微生物—3-O-酰基氨酸—肠道FXR”的肠-肝信号轴的调节改善主代谢的新机制。
总而言之,该研究展示了C. minuta和其产物3-O-酰基胆酸在治疗包括T2D在内的代谢性疾病方面潜力,该结论在小鼠模型中得到了证实,并得到了人群队列研究的支持,再次强调了肠道共生菌及其功能代谢产物在宿主代谢稳态中的重要作用,为代谢性疾病的治疗和预防提供了全新的思路。
参考文献
Liu C, Du MX, Xie LS, et al. Gut commensal Christensenella minuta modulates host metabolism via acylated secondary bile acids. Nat Microbiol. 2024.
请扫描二维码阅读原文

绘谱帮你测
麦特绘谱为本论文实验动物样本提供Q300定量代谢组学分析。麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱拥有Q1000,Q500、Q300、Q200和胆汁酸、短链脂肪酸、色氨酸及吲哚衍生物、多胺和TMAO类等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章400+篇,累计影响因子4000+,平均IF>10,包括Cell, Nature, Science, Cell Metabolism, Immunity, Gut, Hepatology, Microbiome等顶级期刊。
END
