NLRP3是一种炎症小体传感器蛋白,在许多疾病中都进行过大量的研究。激活NLRP3会产生包括ASC与Caspase-1等在内的寡聚体复合物。该寡聚体蛋白复合物被称为“炎症小体(Inflammasone)”,当复合物中的传感器蛋白为NLRP3时,则该复合物被称为NLRP3炎症小体。通过激活其它炎症小体传感器蛋白可触发炎症小体的形成,其它的传感器蛋白比如AIM2、NLRP1与NLRC4等,这些例子中炎症小体传感器蛋白就是炎症小体复合物的一部分。某些炎症小体传感器可直接识别损伤相关分子模式(damage associated molecular patterns, DAMP)或病原相关分子模式(pathogen associated molecular pattern, PAMP)。比如,NLRP1B识别炭疽致死毒素,NLRC4识别细菌鞭毛蛋白,AIM2识别胞质DNA。另一方面,NLRP3依赖于细胞内第二信使,而不是直接检测外部刺激。 NLRP3的激活可由多种细胞内信号触发。 钾外流是NLRP3炎症小体激活最具代表性的触发因素之一。 NLRP3还对其它细胞内信号应答,例如活性氧(Reactive oxygen species,ROS)和细胞质组织蛋白酶活性。将多种不同的炎症小体触发因素整合到第二信使信号(如钾外流)中,可以解释为什么NLRP3在如此众多的炎症疾病中显得至关重要。炎症小体激活受炎症小体传感器蛋白以外的复杂分子相互作用调控。了解该通路及其分子间相互作用可以勾勒出炎症小体药物开发的其他潜在途径。
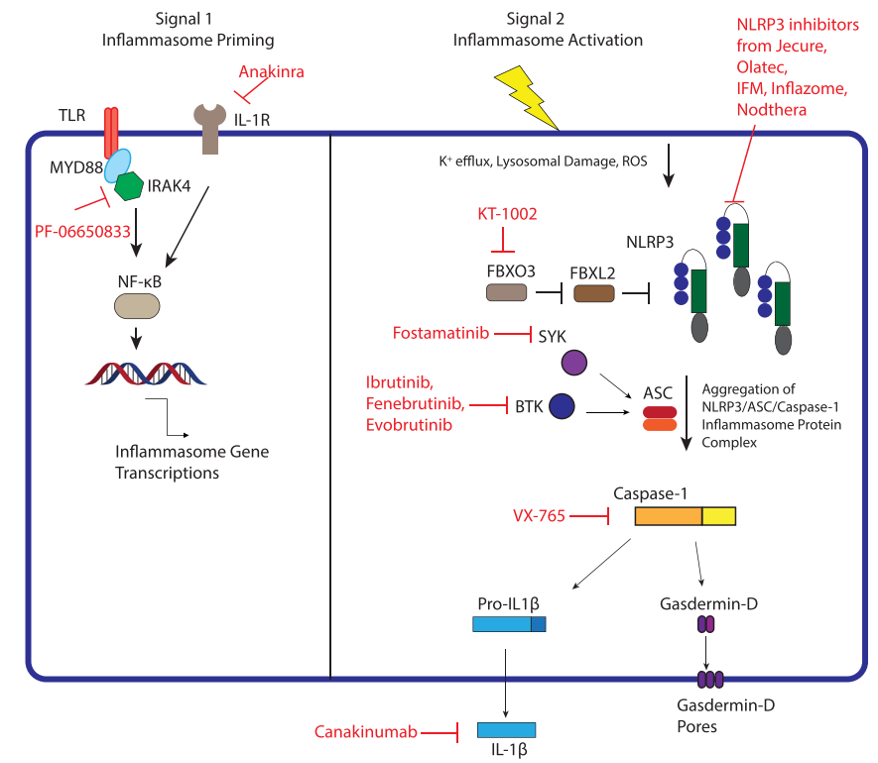
炎症小体的激活由两个关键步骤介导:引发(priming, 通常称为信号1)和激活(通常称为信号2)。引发包括通过上调NF-κB转录活性来上调与炎症小体相关的蛋白(包括炎症小体传感器蛋白,IL-1β和IL-18)。NF-κB的转录活性受到许多细胞内和细胞外机制的高度调节。NF-kB通过IkB在胞浆中处于失活状态。IκB的翻译后修饰或泛素化是对细胞外刺激信号传导的反应,导致细胞核定位和NF-κB的激活。细菌组分通过TLR结合并通过Myd88、IRAK以及TRAF6的信号转导来激活NF-κ B转录活性。诸如IL-1β和TNFα之类的细胞因子也像其他诸如S100a8/a9等之类的DAMP一样激活NF-κB转录活性。在没有NF-κB引发的情况下,许多细胞没有表达足够的炎症小体成分以用于信号2处理后的炎症小体活化 。特别是,许多细胞在不存在信号1的情况下不表达高水平的pro-IL-1β。这会导致在信号2上形成ASC斑点,但不会伴随分泌IL-1β。 已经有许多抑制NF-κB活化策略的报道,但这些策略不在本综述的范围之内。
在正常情况下,信号2触发了炎症小体传感蛋白与炎症小体接头蛋白的聚集,并激活Caspase的募集。在NLRP3的情况下,信号2导致NLRP3与ASC的结合与caspase-1募集。 这种大的蛋白聚集在免疫荧光测定中显示为亮点。Pro-Caspase-1的聚集导致自蛋白水解并产生酶活性的Caspase-1。反过来,Caspase-1切割pro-IL-1β为IL-1β,并且将gasdermin-D切割为N-末端gasdermin-D。 N端gasdermin-D形成膜孔,导致细胞凋亡和IL-1β分泌。
部分内容引用《靶向NLRP3炎症小体的策略》,如有侵权,请联系小编处理~
