近年来,放疗与免疫检查点阻断(ICB)的联合应用在临床模型实验中显示出巨大的潜力,但在实际临床应用中却并非一帆风顺。虽然一些临床试验确实取得了令人鼓舞的成果,但也有一些试验,尤其是在头颈部肿瘤、晚期皮肤肿瘤或对ICB耐药的非小细胞肺癌(NSCLC)患者中,未能达到预期效果。这让人不禁思考:到底是什么因素在影响这种联合疗法的效果呢?
2025年3月,汕头大学医学院附属肿瘤医院陈创珍团队与法国古斯塔夫·鲁西癌症中心等全球多个机构合作,在Cancer Cell上发表了题为:“Low-dose irradiation of the gut improves the efficacy of PD-L1 blockade in metastatic cancer patients” 的论文,该研究表明肠道低剂量辐射(ILDR)不仅能够改善肠道微生物群的组成,还能增强免疫检查点阻断治疗的效果,该研究也为破解免疫治疗耐药难题带来了新的方向。

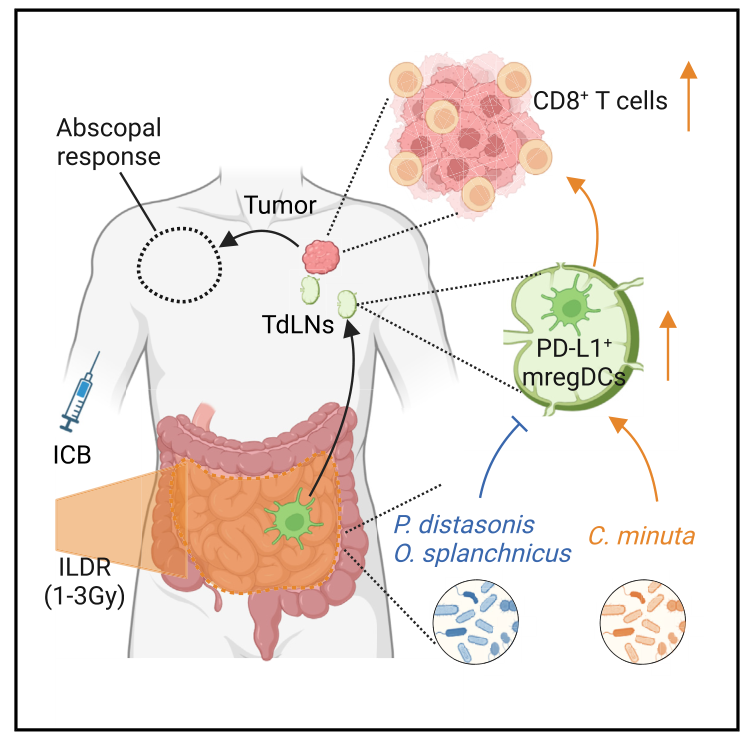
技术路线图
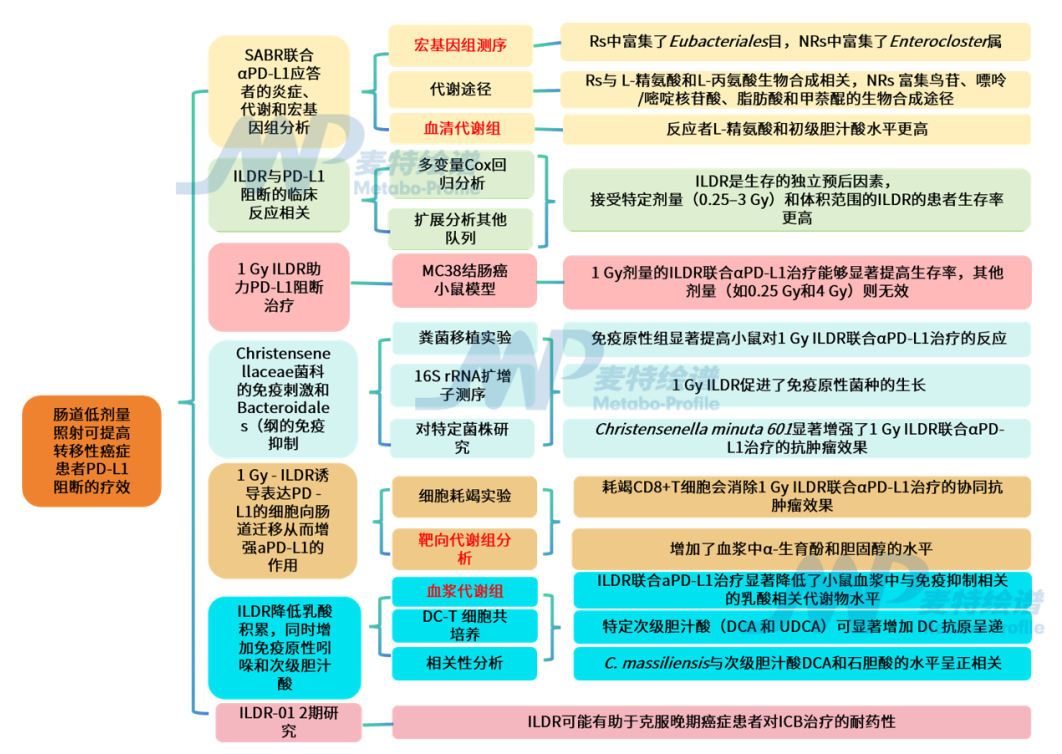
研究结论
1. 19%的晚期癌症患者在SABR(立体定向消融放疗)和PD-L1阻断后长期存活
对接受SABR和PD-L1阻断联合治疗的转移性肿瘤患者进行研究,结果发现这些患者的2年生存率为19%,2年生存者的肿瘤客观反应率(ORR)为67%,显著高于非生存者。
2. SABR联合αPD-L1应答者的炎症、代谢和宏基因组分析
宏基因组测序分析方面:对48份粪便样本进行宏基因组测序,结果发现,反应者(Rs)和非反应者(NRs)在基线时的α多样性和β多样性没有显著差异,但存在某些微生物种类的差异。Rs中富集了Eubacteriales目,NRs中富集了Enterocloster属。与健康志愿者(HVs)相比,Rs中某些有益菌(如C. minuta、R. bromii)的丰度更高,而NRs中某些与耐药相关的菌种(如E. aldensis、P. distasonis)的丰度更高。
代谢途径方面:Rs与 L-精氨酸和L-丙氨酸生物合成相关,NRs富集鸟苷、嘌呤/嘧啶核苷酸、脂肪酸和甲萘醌的生物合成途径,这些途径与DNA损伤和免疫反应有关。
血清代谢组分析方面:反应者——OS24-Rs(总体生存率[OS]≥24个月)和OS12Rs(生存率[OS]≥12个月)的L-精氨酸和初级胆汁酸水平更高,而非反应者(OS12 NRs)的羧酸、单/多不饱和脂肪酸、穿梭肉碱、甲基萘醌生物合成和乙酰化多胺水平更高。
炎症因子差异方面:IL-7和IFN-γ分别是OS12的Rs和NRs的特征性细胞因子,二者检测结果几乎互斥且分别与良好和不良生存相关。缺乏IL-7的患者表现出与放化疗耐药相关的口腔菌群的增加;IFN-γ阳性患者表现出与健康相关的细菌减少。
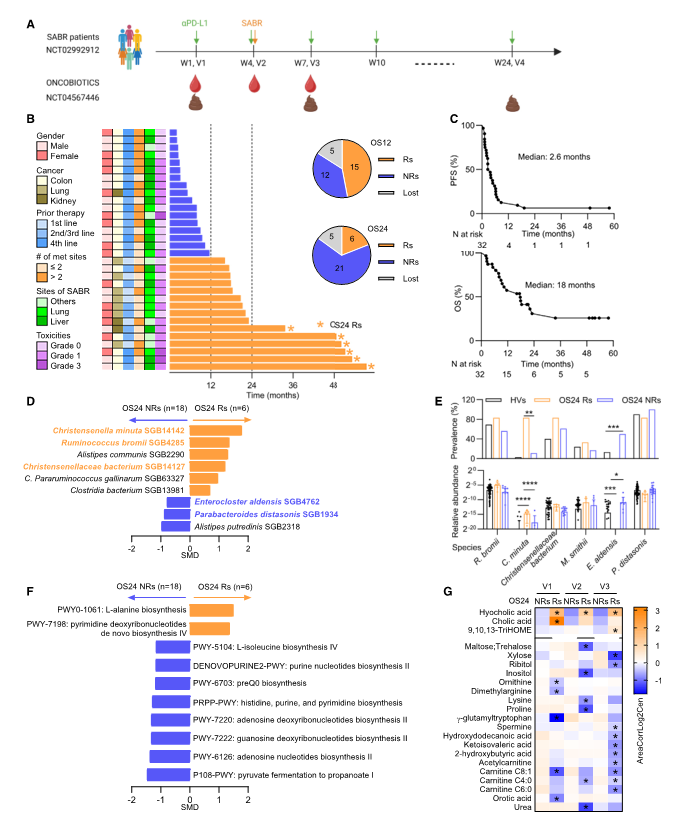
图1. 长期存活的患者拥有健康的微生物群
3. ILDR与PD-L1阻断的临床反应相关
在SABR试验中,接受ILDR的患者比未接受ILDR的患者更易达到2年生存(OS24 R状态)。作者进一步通过多变量Cox回归分析显示,ILDR是生存的独立预后因素,优于血清IL-7和MSI-H状态。并且通过扩展分析多个队列,发现接受特定剂量(0.25–3 Gy)和体积范围的ILDR的患者生存率更高。
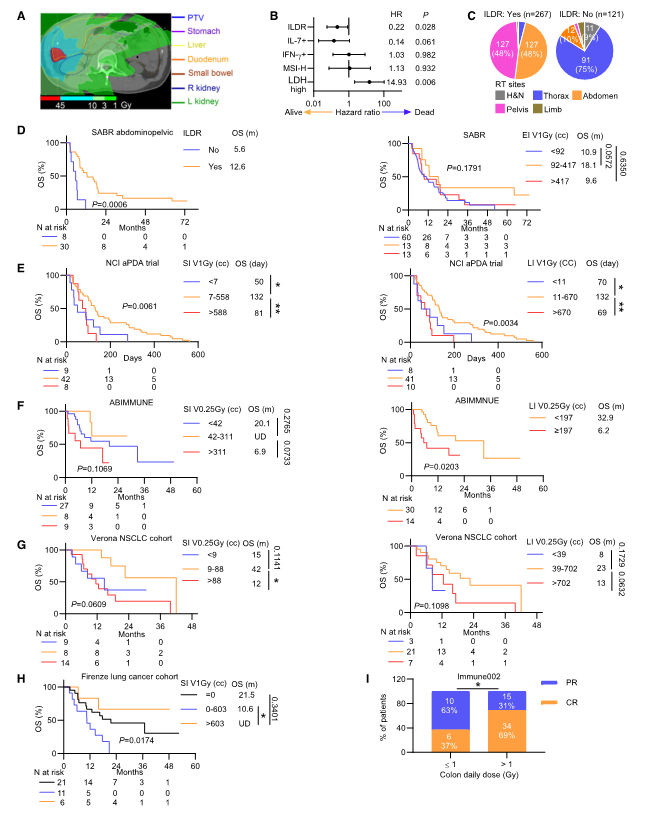
图2. ILDR与临床获益和长期生存相关
4. 1 Gy ILDR助力PD-L1阻断治疗
利用MC38结肠癌小鼠模型进行研究,发现1 Gy剂量的ILDR联合αPD-L1治疗能够显著提高生存率并治愈了30%的小鼠,而其他剂量(如0.25 Gy和4 Gy)则无效。
5. Christensenellaceae菌科的免疫刺激和Bacteroidales(拟杆菌)纲的免疫抑制
选取8名患者的粪便样本进行粪菌移植实验,有4份样本的供体(免疫原性组)能够显著提高小鼠对1 Gy ILDR联合αPD-L1治疗的反应。进一步使用16S rRNA扩增子测序,分析小鼠粪便样本中的微生物群落组成,结果发现1 Gy ILDR促进了免疫原性菌种(如Lacrimispora aerotolerans、Odoribacter splanchnicus、Ruminococcus flavefaciens)的生长,这些菌种能够保护小鼠免受结肠炎和结直肠癌的侵害,并延长寿命。相反,4 Gy ILDR促进了免疫耐受性菌种(如Muribaculum intestinale、Culicoidibacter larvae)的生长。通过对特定菌株的研究,发现Christensenella minuta 601显著增强了1 Gy ILDR联合αPD-L1治疗的抗肿瘤效果,而其他菌种(如Odoribacter splanchnicus、Bacteroides fragilis、Bacteroides thetaiotaomicron)则降低了这种效果。此外,Parabacteroides distasonis(一种与耐药相关的菌种)的存在与较短的生存期相关,并且通过qPCR验证其在小鼠粪便中的定植,发现其能够减少1 Gy ILDR联合αPD-L1治疗的效果,同时增加血浆中脱氧鸟苷的浓度。
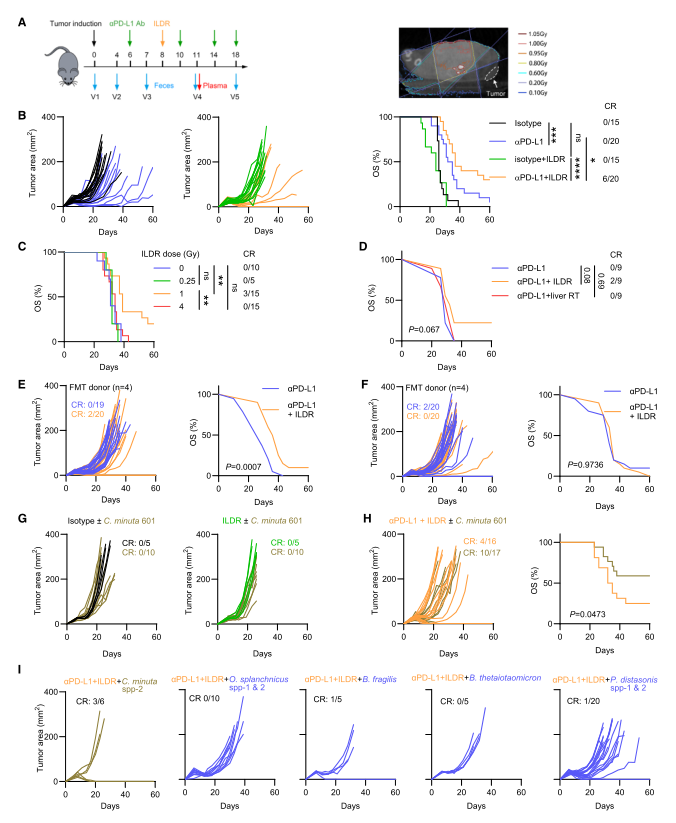
图3. ILDR和PD-L1阻断的协同抗癌作用涉及不同的肠道共生体
6. 1 Gy-ILDR诱导表达PD-L1的肠道树突细胞和效应CD8+T细胞向肠道迁移从而增强aPD-L1的作用
通过细胞耗竭实验发现,耗竭CD8+T细胞会消除1 Gy ILDR联合αPD-L1治疗的协同抗肿瘤效果,而耗竭CD4+T细胞则没有这种影响。通过肿瘤浸润淋巴细胞(TILs)分析发现,1 Gy和4 Gy ILDR均增加了MC38肿瘤中CD8+T细胞、调节性T细胞(Tregs)和记忆T细胞的浸润。4 Gy ILDR增加了CD8+T细胞表达耗竭标志物TOX的频率,此外,1 Gy ILDR减少了肠道Tregs和RORγt+Tregs(Tr17)细胞的系统循环,从而增加了TILs肠道T细胞外迁的CD8/Treg比率。
对接受1 Gy ILDR联合aPD-L1治疗的小鼠血浆进行靶向代谢组分析,1 Gy ILDR联合αPD-L1治疗增加了血浆中α-生育酚和胆固醇的水平,但降低了2-(OH)-3-甲基丁''酸和异丁''酸的水平。在DC-T细胞共培养系统中,1–3 Gy的辐射剂量显著增强了DCs(肠道树突状细胞)的抗原呈递能力,而0.25 Gy、4 Gy或6 Gy的剂量则没有这种效果。
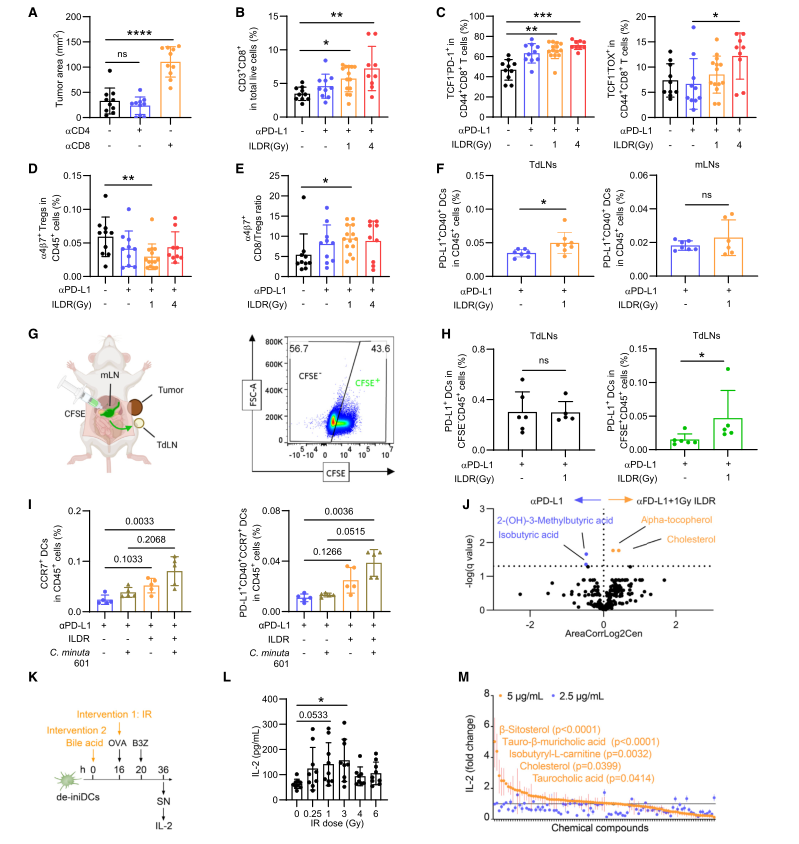
图4. LDR联合αPD-L1治疗方案对mregDC-CD8+T细胞依赖性效应
7. ILDR降低乳酸积累,同时增加免疫原性吲哚和次级胆汁酸
对接受ILDR联合aPD-L1治疗的荷瘤小鼠进行血浆代谢组分析,结果发现ILDR联合aPD-L1治疗显著降低了小鼠血浆中与免疫抑制相关的乳酸相关代谢物水平。DC-T 细胞共培养系统表明,特定次级胆汁酸(DCA 和 UDCA)可显著增加 DC 抗原呈递。进一步相关性分析显示C. massiliensis与次级胆汁酸DCA和石胆酸的水平呈正相关。在患者中,Christensenella minuta在整个SABR治疗过程中保持稳定,且与次级胆汁酸(如牛磺胆酸)以及多种已知的免疫刺激性代谢物(如精氨酸、吲哚-3-丙''酸和甲基吲哚-3-乙酸)相关。总体而言,ILDR通过促进肠道中表达PD-L1的树突状细胞(mregDCs)从肠系膜淋巴结(mLNs)迁移到肿瘤引流淋巴结(TdLNs),增强了PD-L1阻断的免疫刺激效果。
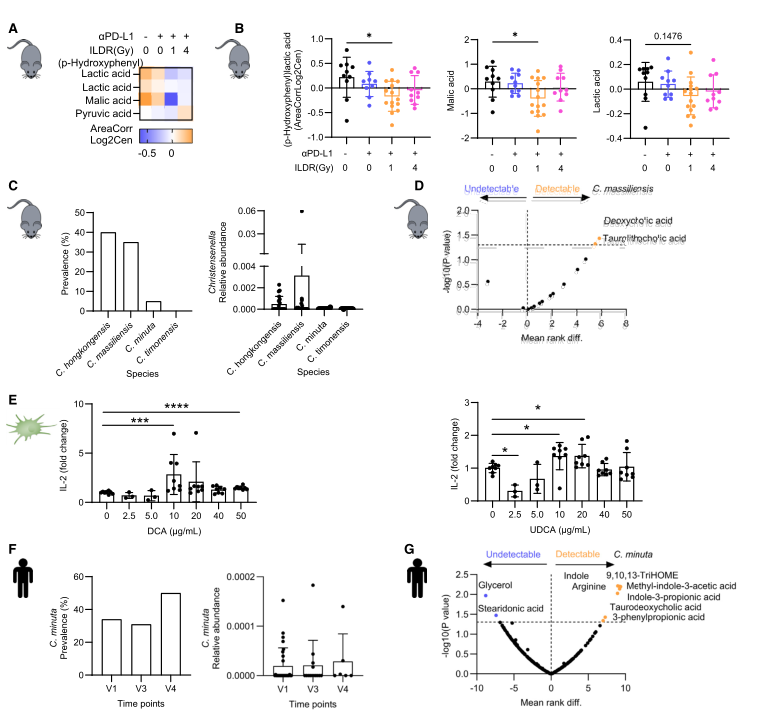
图5. 与C. minuta相关的代谢物增强了树突状细胞的交叉呈递功能
8. ILDR-01 2期研究:针对对PD-1阻断治疗耐药的癌症患者
该研究启动了一项2期临床试验(ILDR-01),纳入了对一线或二线免疫治疗耐药的晚期转移性实体瘤患者,并对首批接受 ILDR且未接受癌症靶向放疗,随后接受至少1个周期免疫检查点阻断(ICB)治疗的10例患者的临床结果进行分析。治疗结果显示,10例患者中有2例部分缓解(PR)、5例病情稳定(SD)、3例疾病进展(PD)。总体而言,ILDR可能有助于克服晚期癌症患者对ICB治疗的耐药性。
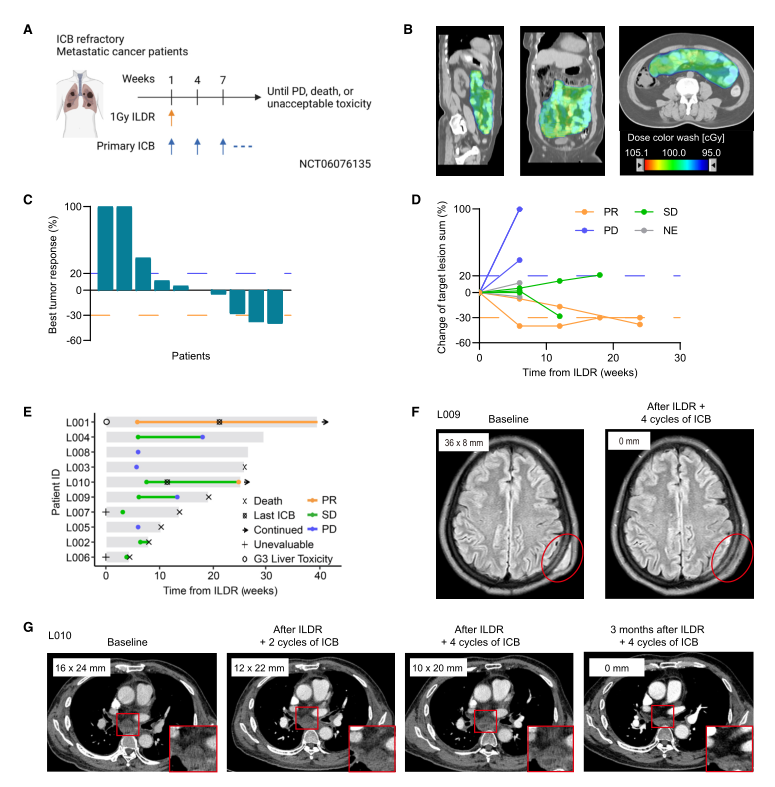
图6. ILDR在一项2期前瞻性试验中克服了对ICB的耐药性
小结
本研究揭示了肠道低剂量辐射(ILDR)在癌症免疫治疗中的潜在作用,此外,阐述了ILDR通过调节肠道微生物群和代谢物,增强了树突状细胞的抗原呈递能力,从而提高治疗效果,为优化免疫治疗方案和开发新的治疗方法提供了重要的理论和实践基础。
参考文献
Chen J, Levy A, Tian AL, et al. Low-dose irradiation of the gut improves the efficacy of PD-L1 blockade in metastatic cancer patients. Cancer Cell. 2025
绘谱帮你测
麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱拥有Q1000,Q500、Q300、Q200和胆汁酸、短链脂肪酸、色氨酸及吲哚衍生物、多胺和TMAO类等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章500+篇,累计影响因子5000+,平均IF>10,包括Cell, Science, Nature, Cancer Cell, Signal Trans-duction and Targeted Therapy, Nature Biotechnology, Cell Metabolism等权威期刊。
