
期刊:Metabolism-Clinical And Experimental
影响因子:9.8
伯豪技术服务:RNA-seq
导读
肥胖作为一个世界性的健康问题,越来越受到人们的关注。本研究鉴定了一种在包括小鼠和人类间高度保守的长非编码RNA NRON,是葡萄糖/脂质代谢和全身能量消耗的重要调节因子。Nron的缺失会给DIO(饮食诱导肥胖)小鼠带来代谢益处,包括减轻体重和脂肪量、改善胰岛素敏感性和血脂参数、减轻肝脂肪变性和增强脂肪功能。研究发现,NKO(Nron 敲除)小鼠对由高脂肪饮食(HFD)引起的肥胖导致的代谢异常具有高度抵抗力。从机制上讲,Nron的缺失会诱导肝脏中FGF21的表达,并缓解FGF21的抵抗状态,从而通过AMPK依赖性方式减轻肝脏脂肪变性。此外,研究还发现Nron缺失增强了脂肪组织中的儿茶酚胺敏感性和脂质循环活性,对增加HFD喂养期间的能量消耗有很大贡献。这些效应共同维持NKO小鼠更健康的代谢表型。
研究技术
RNA-seq、代谢组、脂质组
研究路线
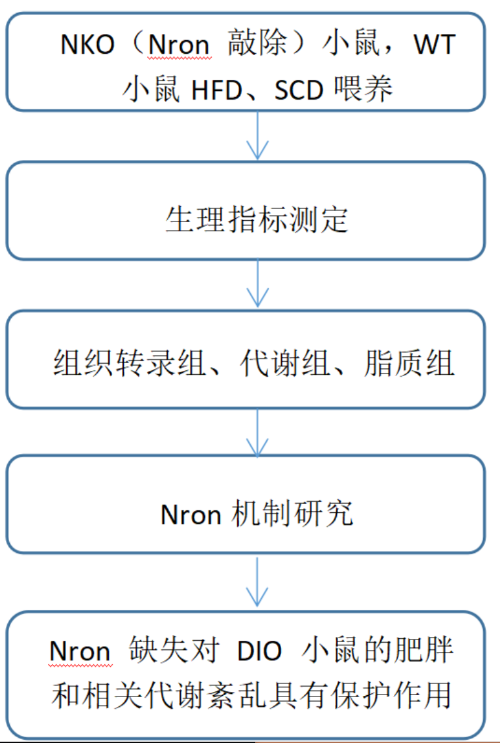
研究结果
1. NKO 小鼠免受饮食引起的肥胖
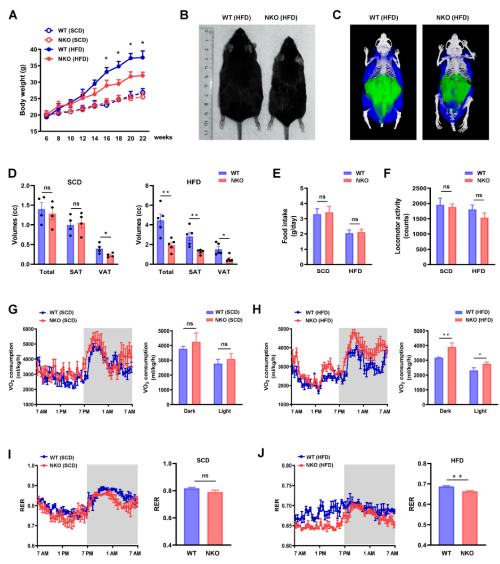
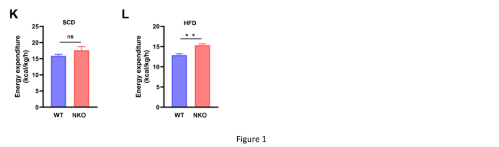
NKO小鼠和WT野生型小鼠都接受HFD和SCD(标准对照饮食)喂养,SCD喂养组中没有体重差异,而与WT小鼠相比,HFD喂养的NKO小鼠体重明显减少(图1A、1B)。CT扫描进行的身体成分分析也表明,NKO小鼠的脂肪量较少,SCD喂养的内脏脂肪和和HFD喂养的内脏脂肪、皮下脂肪均减少(图1C、1D)。为了更好地了解肥胖减少的原因,研究人员对仅接触HFD 6 周(体重出现差异之前)的小鼠进行了全身能量代谢研究。不同基因型之间的食物摄入量和运动活动没有差异(图 1E、1F)。在HFD喂养条件下,NKO小鼠的总耗氧量明显高于WT幼崽(图1G、1H),呼吸交换比(RER)降低(图1I、1J),表明脂肪酸被用作优先的能量底物。此外,NKO小鼠在HFD喂养期间计算的每日能量消耗也增加(图1K和1L)。
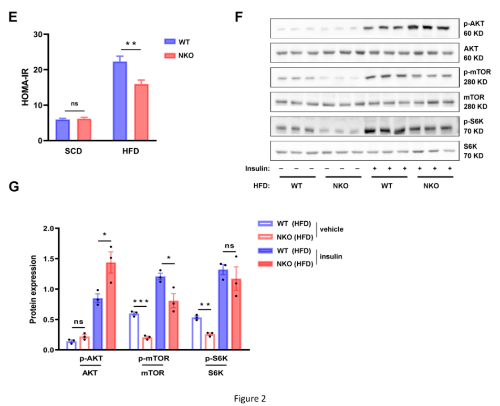
2. NKO小鼠具有更高的葡萄糖耐受性和胰岛素敏感性
对葡萄糖的稳态测定发现,在HFD喂养6周后,在两组之间的体重没有差异的情况下,NKO小鼠表现出更好的葡萄糖和胰岛素耐受能力(图2A- 2D)。NKO小鼠的 HOMA-IR 值(胰岛素抵抗指标)也较低(图2E)。此外,还评估了肝脏中的胰岛素信号传导,发现NKO小鼠中胰岛素诱导的AKT磷酸化比WT小鼠更明显增加,但mTOR/S6K磷酸化没有相应增加(图2F、2G) 。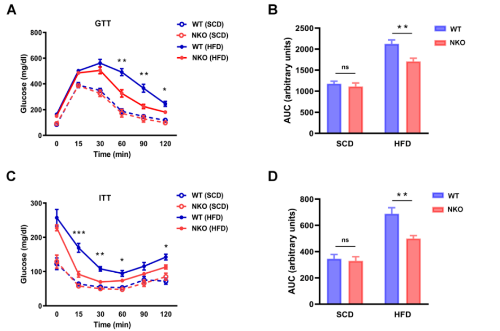
3. NKO小鼠不受HFD诱导的肝脂肪变性
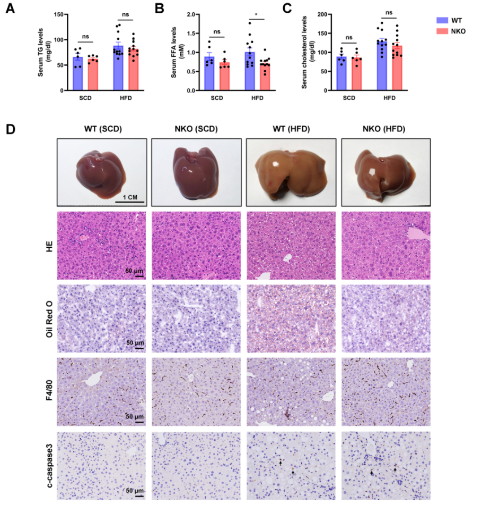
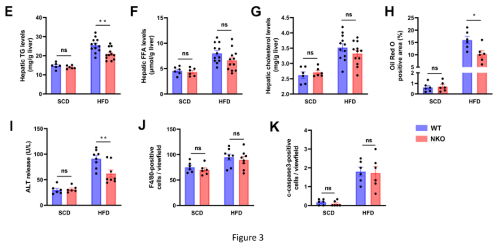
对小鼠的血清和肝脏脂质代谢测定结果发现,HFD喂养条件下NKO小鼠血清游离脂肪酸 (FFA)水平显著低于WT小鼠。但是,血清甘油三酯(TG)和胆固醇水平没有显着差异(图3A-3C)。值得注意的是,肉眼观察、油红O染色和肝脂质定量显示,HFD条件下,NKO小鼠的肝脏脂肪变性较少,肝脏中TG的积累减少(图3D-3E、3H)。肝脏游离脂肪酸和胆固醇含量无明显变化(图3F、3G)。此外,NKO小鼠的ALT水平显着降低(图3I)。但是,通过 F4/80 或 c-caspase3 染色的组织学分析,没有观察到肝脏炎症和细胞凋亡的差异(图3J 、3K)。
4. 小鼠肝脏RNA-Seq和代谢组学
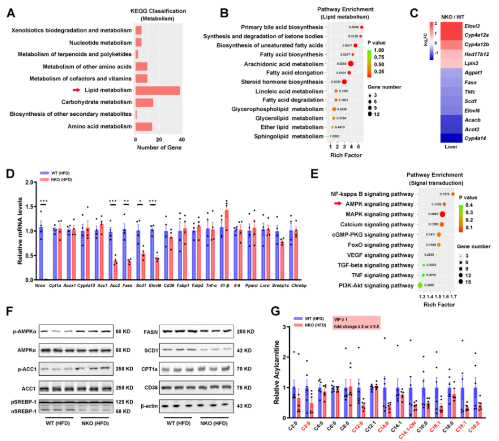
为了深入了解 NKO对肝脂肪变性保护作用的分子过程,对HFD喂养的WT和NKO小鼠进行mRNA-seq测序,分析得到403个下调基因,304个上调基因。脂质代谢通路在NKO肝脏中显富集(图 4A 和 4B)。由于NKO肝脏中TG和FFA沉积减少,重点研究了与脂肪酸和甘油脂代谢相关的基因表达的变化,发现参与脂肪形成的基因(AcacB、FASN、SCD1、Elovl6)在NKO肝脏中都比WT组下调(图4C)。QPCR证实了这一结果(图 4D)。然而,与FA摄取(CD36、Fabp1、Fatp2)、FA氧化(CPT1a、Acox1、Cyp4a10)以及炎症(Tnf-α, Il1-β, and Il-6)相关的基因在两组中的表达没有差异(图4E)。但Nron缺失既不影响p65的磷酸化,也不影响炎症基因的表达(图4D)。相比之下,观察到NKO肝脏中 AMPK的激活增加,SREBP-1靶基因FASN 和SCD1 的蛋白质水平持续下降(图 4F)。另外,观察到HFD喂养的NKO小鼠肝脏中的中链和长链酰基肉碱显著减少(图 4G),血清β-羟基丁酸的增加也明显改善了FAO(图4H)。QPCR结果显示,与 WT 小鼠相比,NKO 小鼠肝脏中的Fgf21有所增加(图 4I)。HFD 喂养期间,两组的血清中FGF21表达逐渐增加,但在NKO小鼠中FGF21水平在在整个16 周HFD喂养期间维持在较高水平(图 4J),相反,在基础条件下,WT 和 NKO 小鼠的脂联素和瘦素血清水平没有差异。本研究中,证明 NKO 小鼠肝脏中的 FGF21 蛋白水平肯定升高,而脂肪组织中的FGF21蛋白水平没有变化(图 4K)。为了测试这些效应是否是细胞自主的,从 WT 和 NKO 肝脏中分离出原代肝细胞,NKO 肝细胞中FGF21 的蛋白水平随着 AMPK 激活和 SREBP-1/FASN抑制而升高,但当FGF21 被敲低时,这种影响被消除(图4L)。同样,油红O染色和TG定量显示,FGF21敲低完全消除了Nron缺失对培养肝细胞脂质沉积的保护作用(图4M和N)。
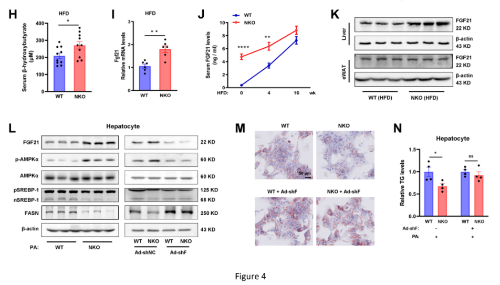
5. Nron与KPNB1相互作用调节PER2/Rev-Erbα/FGF21
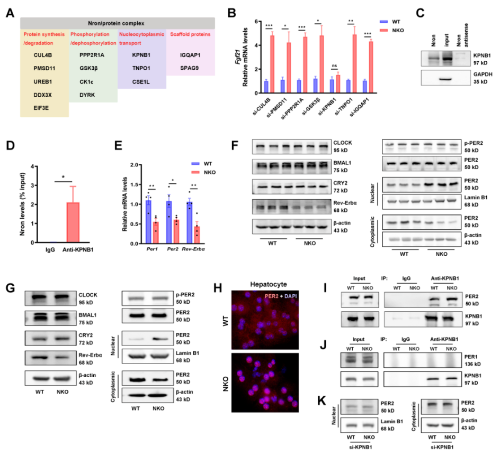
据报道,Nron 与几种不同的蛋白质成分相互作用,这些蛋白质成分参与翻译后修饰和信号转导,或参与蛋白质周转和核质运输,或充当支架蛋白(图 5A)。作者首先通过功能缺失实验研究了这些蛋白在FGF21表达中的作用,发现NKO细胞中FGF21的诱导被KPNB1敲低所抵消(图5B)。此外,Nron与KPNB1的相互作用通过RNA Pull-down(图5C)和RNA免疫沉淀测定(图5D)进行了验证。几个核心生物钟基因(Per1、Per2、Rev-Erbα)在NKO小鼠的肝脏中下调,QPCR验证结果一致(图5E)。接下来用肝脏原代细胞确定了昼夜节律成分的蛋白质水平(图5G)。用免疫荧光测定证实了NKO 肝细胞中PER2的显着核定位(图5H)。此外,研究还发现在免疫共沉淀分析中PER2与KPNB1相互作用,并且这种相互作用在NKO肝细胞中显着增加(图5I)。相反,Period家族的另一个成员PER1不与KPNB1 结合(图5J)。相应地,KPNB1的敲低完全逆转NKO肝细胞中PER2增加的核积累(图5K)。PER2的敲低消除了NKO肝细胞中FGF21的诱导,并且Rev-Erbα的联合敲低恢复了FGF21水平,而Nron OE减少了FGF21的表达,并且Rev-Erbα敲低完全逆转了抑制(图5L、5M)。Fgf21荧光素酶报告结果显示,与WT组相比,NKO细胞的荧光素酶活性显著增加(图5N)。根据研究结果,作者认为Nron通过KPNB1/PER2/REV-Erbα轴调节FGF21的表达。接着,还检测了Nron对核心clock基因表达的影响,发现Nron缺乏并不影响clock和Bmal的节律性(图50),这与的RNAseq结果一致。
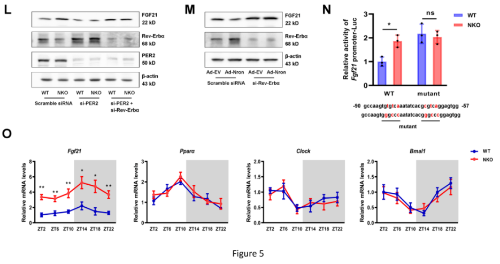
6. Nron缺失可通过FGF21减轻肝脏脂肪变性
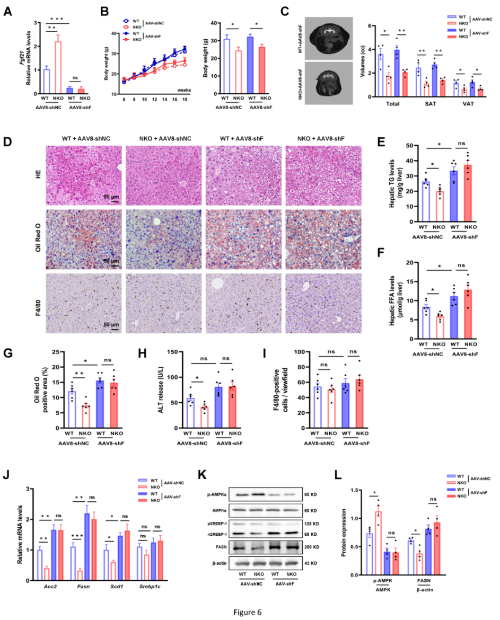
为了确定NKO小鼠的表型可能是FGF21诱导肝脏的结果,制备了携带FGF21 shRNA的AAV8(AAV8-shFGF21),然后将其静脉注射到WT和NKO小鼠体内,以诱导肝脏中FGF21的敲除(KD)。KD肝脏中FGF21的含量降低了70%以上(图6A)。值得注意的是,即使在FGF21被敲除的情况下,接受HFD喂养的NKO小鼠的体重和脂肪质量也低于WT小鼠(图6B、6C)。然而,NAFLD的改善完全减弱(图6D-6I),表明FGF21依赖对肝脏脂肪变性的保护作用。同样的,当FGF21被击倒时,NKO小鼠AMPK的激活和对脂肪生成的抑制完全被取消(图6J和L)。
7. Nron缺失促进脂肪细胞脂解
为了更清楚地阐明Nron对能量代谢的作用机制,对脂肪组织进行研究,组织学分析和细胞大小定量显示,HFD喂养的NKO小鼠的表皮脂肪细胞比对照组小(图7A-7C),NKO小鼠的脂肪组织巨噬细胞和冠状结构的数量少于WT小鼠(图7A、7D)。此外,对EPWAT中代谢中间产物的分析显示,NKO小鼠中与三羧酸(TCA)循环相关的代谢物急剧增加,包括终末代谢物琥珀酸和富马酸,此外,还观察到环腺苷一磷酸(cAMP)水平升高(图7E和7F)。接着使用p-(Ser/Thr) PKA底物抗体来检测脂肪PKA底物,并证明在NKO小鼠的epiWAT中PKA活性确实增强(图7G)。NKO 和 WT 外植体之间的基础甘油和FFA释放没有差异,但NKO小鼠的epiWAT中ISO刺激的甘油和 FFA 释放显着增加。相反,胰岛素对脂肪分解的抑制作用不受影响(图7I、7J)。从NKO和 WT小鼠中分离出附睾SVF,并刺激其分化为脂肪细胞,然后进行脂肪分解测定。Nron 敲除不影响脂肪分化(图7K 和L)。在分化的NKO脂肪细胞中,ISO刺激的甘油和FFA释放仍然增加(图7M和N),同时伴随着PKA活性和HSL磷酸化的增强(图7O),表明 Nron 具有脂肪分解的细胞自主功能。当 FGF21 被敲低时,在NKO小鼠中观察到的脂肪分解增加被保留(图7P)。相比之下,尽管血清FGF21水平与对照组相比显着增加,LiNKO小鼠没有表现出脂肪分解改变(图7Q)。
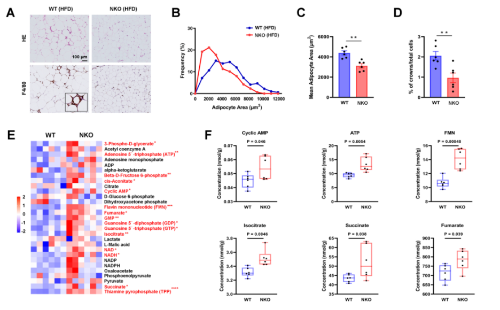
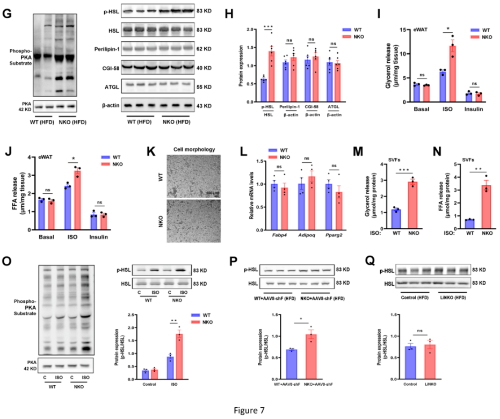
8、Nron 缺失增加脂肪组织中的脂质周转
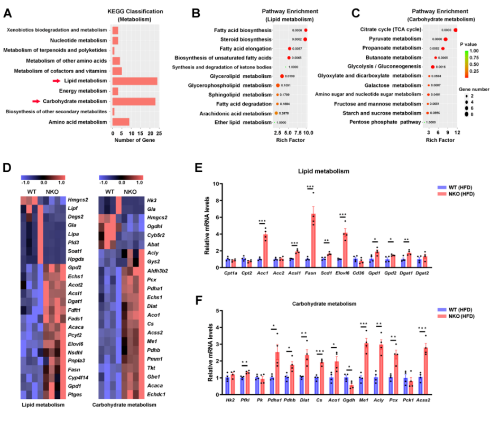
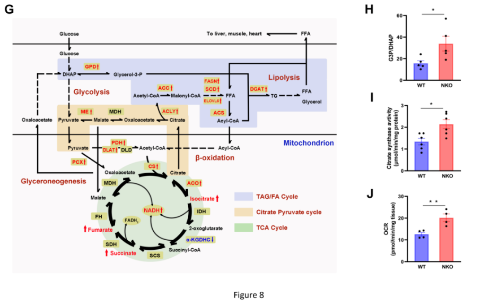
使用HFD喂养的WT和NKO小鼠进一步进行EpiWAT的微阵列转录组分析。KEGG通路分析结果表明脂质和碳水化合物代谢通路显著富集(图8A-8D),并通过QPCR对结果进行验证(图8E和F)。并发现上调的基因主要与FA合成(Acc1、Acsl1、Fasn、Scd1和Elovl6)、甘油三酯合成(Gpd1、Gpd2、Dgat1)、柠檬酸-丙酮酸循环(Acly、Me1)和TCA循环(Pdha1、Pdhb、Dlat、Cs、Aco1)相关(图8G),另外PCX和GPD1在NKO小鼠中显著上调(图8E-G),G3P/DHAP比率显著增加(图8H)、有氧能力的指标柠檬酸合成酶(CS)的活性也增加(图8I)。为了进一步评估脂肪组织的耗氧量,对饲喂高脂饲料6周的小鼠的WAT外植体进行了细胞外流量分析结果发现,NKO小鼠的脂肪组织显示出比WT小鼠显著更高的耗氧率(OCR)(图8J),表明线粒体呼吸能力增加。
参考文献:
Please cite this article as: B. Liu, Y. Zhong, D. Huang, et al., LncRNA Nron deficiency protects mice from diet-induced adiposity and hepatic steatosis, Metabolism (2023), https://doi.org/10.1016/j.metabol.2023.155609
