导读目录
1. Nature Genetics | 孟德尔随机化分析支持血液代谢物与肠道微生物组之间的因果关系
2. Molecular Cell | ASS1介导的瓜氨酸消耗促炎症巨噬细胞激活和免疫反应
3. Cell Metabolism | STING调节多不饱和脂肪酸代谢和炎症反应之间的串扰
4. Advanced Science | 调控肿瘤内菌群和代谢或可解除肿瘤治疗耐药性
5. Gut Microbes | 代谢组+16S共同揭示饮食促进抗生素耐药基因在小鼠肠道菌群中的传播
6. Nature Communications丨母体肠道菌群代谢物调节新生儿胆道疾病
7. Nature Communications | 肠道微生物通过调节胆汁酸组成和胆汁胆固醇分泌促进胆固醇结石形成
8. Gut | 肠道微生物群通过 PUFA 相关的神经炎症调节阿尔茨海默病的病理和认知障碍
一. Nature Genetics | 孟德尔随机化分析支持血液代谢物与肠道微生物组之间的因果关系

肠道微生物组与多种生理疾病相关,但之间的因果关系仍未得到很好的解释。本研究对3432名中国个体进行了双向孟德尔随机分析,包括全基因组、全亚基因组、人体测量和血液代谢特征数据,阐释菌群与疾病的因果关系。
1. 对 3,432 例样本(发现队列 2002 例,重复队列1430例)的微生物特征进行宏基因组全基因组关联研究 (M-GWAS);对发现队列的血液代谢物结果进行重复验证,对 500 种微生物特征与 112 种血液代谢物进行相关性分析,观察到 457 个显著关联;
2. 对上述显著关联的微生物特征与血液代谢物进行单样本 MR 分析以推断彼此的因果关系。观察到 58 个显著的因果效应,其中具有因果关系的微生物特征与血液代谢物中, 有 43 个被成功复制(方向相同且 P < 0.05 );
3. 因果效应最显著的是 Oscillibacter → 降低血液甘油三酯浓度;Oscillibacter → 降低 BMI;Oscillibacter → 降低腰臀比(WHR);
4. 对 40 种肠道微生物和 12 种血液代谢物与疾病进行因果关系推断,发现 Alistipes 降低脑动脉瘤的风险和肝细胞癌; 变形杆菌增加 T2D 风险、充血性心力衰竭和结直肠癌;大肠杆菌增加了尿石症和肝细胞癌的风险,但降低了间质性肺病的风险;来自日本生物银行的两样本孟德尔随机分组数据部分证实了甘油三酯和尿酸的结果,也为已发表的癌症和心血管疾病粪便细菌标记物提供了因果支持。
Mendelian randomization analyses support causal relationships between blood metabolites and the gut microbiome. Nature Genetics. 2022. https://doi.org/10.1038/s41588-021-00968-y
原文阅读,请扫描下方二维码

二. Molecular Cell | ASS1介导的瓜氨酸消耗促炎症巨噬细胞激活和免疫反应

巨噬细胞是机体抗感染免疫系统的重要组成部分,巨噬细胞的免疫功能受到细胞内外代谢物改变的影响,精氨酸代谢被认为是调节巨噬细胞极化和炎症反应的重要代谢调节因素。本研究揭示了尿素循环的异常改变显著影响了肿瘤细胞的氨代谢和多胺的生物合成能力。
1. 首先诱导小鼠骨髓来源的巨噬细胞发生促炎症极化后,发现其可导致ASS1的表达显著升高,与之相伴随的是其代谢底物瓜氨酸的消耗,而尿素循环中的其他代谢物的水平没有发生显著的变化;
2. 机制探究发现,在巨噬细胞的促炎症极化过程中,JAK2-STAT1信号通路的活化上调了ASS1的转录表达,同时在短时间内迅速磷酸化ASS1的Y87位点,从而提高了ASS1的酶活性和导致细胞内瓜氨酸快速和剧烈的消耗;
3. 更深入的研究验证,ASS1的敲除会导致巨噬细胞中瓜氨酸的累积,而高水平的瓜氨酸会与JAK2直接结合,从而削弱JAK2与IFNγR2和STAT1的结合,抑制JAK2-STAT1信号通路的活性,从而抑制巨噬细胞的促炎极化以及小鼠的抗拒感染能力。
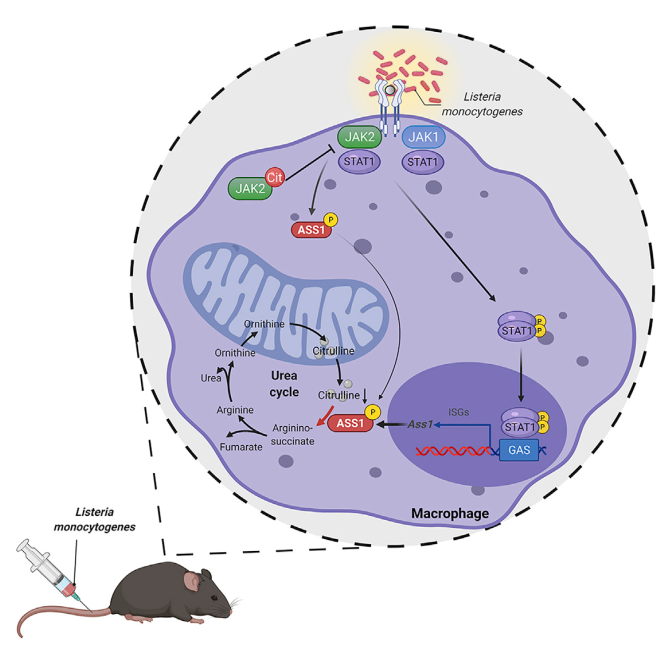
Citrulline depletion by ASS1 is required for proinflammatory macrophage activation and immune responses. Molecular Cell. 2022. https://doi.org/10.1016/j.molcel.2021.12.006
原文阅读,请扫描下方二维码

三. Cell Metabolism | STING调节多不饱和脂肪酸代谢和炎症反应之间的串扰

干扰素基因刺激因子(STING)是核酸相关炎症反应的中枢调节因子。近几年一些研究发现,STING存在某些代谢调节作用,但迄今为止还没有发现STING在代谢中的直接作用。本研究展开了对STING在代谢中的功能研究,发现其与脂肪酸去饱和酶2(FADS2)之间存在一个负向调节循环通路。
1. 研究人员通过sting基因敲除小鼠模型试验,发现其小鼠体内的棕色脂肪组织产热程序自发激活,提示STING蛋白的存在会抑制脂肪细胞组织产热;
2. 随后在sting基因敲除的小鼠胚胎成纤维细胞中稳定表达FLAG和HA标记的STING蛋白,随后通过串联亲和纯化分析,找与STING蛋白直接互作的蛋白——脂肪酸去饱和酶2(FADS2);
3. 通过STING激动剂刺激细胞并分析FADS2下游产物,发现STING抑制FADS2去饱和酶的活性,STING激活则会促进FADS2依赖性的去饱和,导致驱动产热的PUFA衍生物积累;
4. 通过结构分析和子对接分析发现, PUFAs是STING的潜在配体,通过PUFAs以及其他不同种类的脂肪酸测试,发现PUFAs能够介导对STING的特异性抑制作用;
5. 进一步研究发现fads2基因敲除可导致dsDNA诱导的Sting激活增加,通过病毒感染实验发现,shRNA或FADS2抑制剂都能有效降低DNA病毒感染。
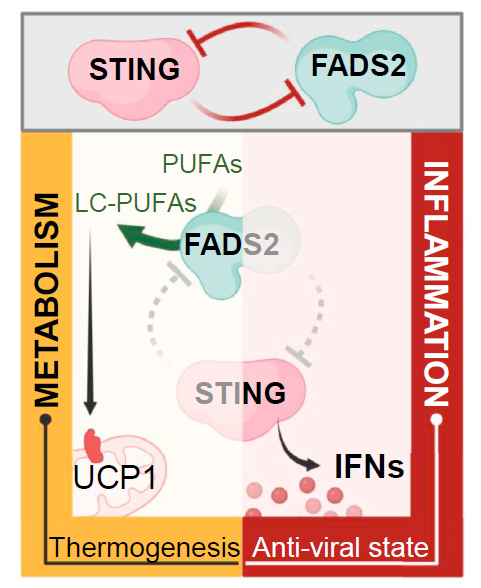
STING orchestrates the crosstalk between polyunsaturated fatty acid metabolism and
Inflammatory responses. Cell Metabolism. 2022. https://doi.org/10.1016/j.cmet.2021.12.007
原文阅读,请扫描下方二维码

四. Advanced Science | 调控肿瘤内菌群和代谢或可解除肿瘤治疗耐药性

肠道菌群多样性及其代谢物多样性决定了肠道菌群的多能性。肿瘤内或肠道菌群与肿瘤的发生和发展相关,菌群调控对加强各种抗肿瘤方法具有重要意义,但缺乏精确的调控方法,其潜在机制尚不清楚。本研究建立了一种菌群代谢工程光疗策略,利用Nb2C/Au细菌工程纳米复合材料和相应的光疗来实现“化学”和“物理”细菌调控。
1. 16S rDNA测序分析结果表明,Nb2C/Au-PVP 在激光照射下的“化学”和“物理”协同杀菌作用可以破坏细菌结构,降低肿瘤内菌群的丰度和多样性;
2. 代谢组学结果表明,与对照组相比,处理组有多种差异代谢物,通路富集结果也显著富集到多个代谢通路,提示这种肿瘤内菌群代谢工程化的抗肿瘤治疗通过直接光疗和微生物代谢紊乱介导对肿瘤代谢产生了显著影响;
3. 负载于Nb2C上的抗肿瘤坏死因子(anti-TNFα)药物,与细菌调节相结合,可激活抗炎信号通路和下调促炎因子(例如,IL-6 和 TNF-α),导致肿瘤内菌群和肿瘤微环境的代谢紊乱,解除肿瘤抗药性,显著增强4T1和CT26肿瘤对光疗的抗肿瘤效果;
4. 该研究明确了菌群调节肿瘤发生的原理,建立了菌群代谢调节方法,为肿瘤治疗提供独特见解,也可以扩展到其他肠道菌群相关的病变治疗上。
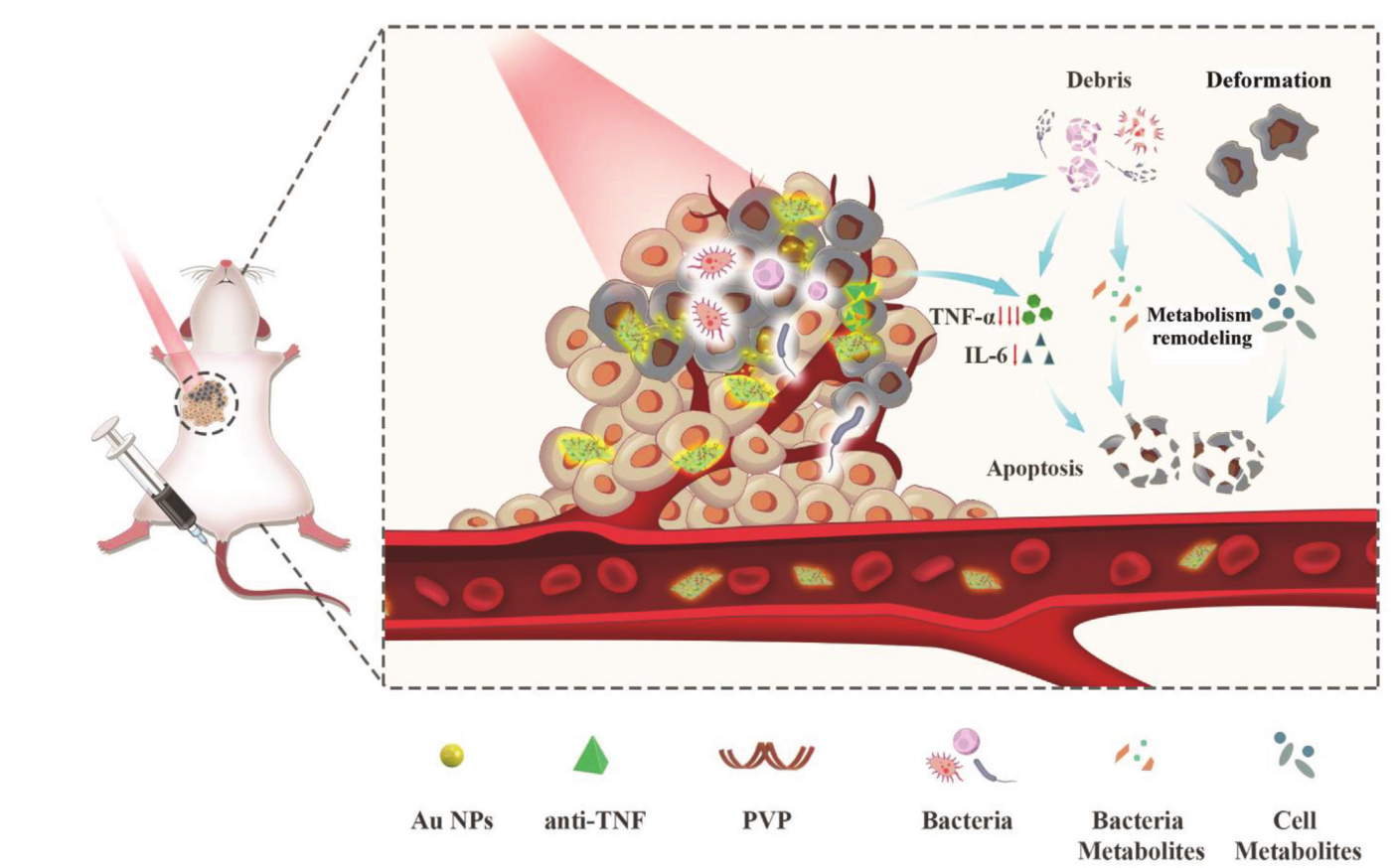
Abundance and Metabolism Disruptions of Intratumoral Microbiota by Chemical and Physical Actions Unfreeze Tumor Treatment Resistance. Advanced Science. 2022. https://doi.org/10.1002/advs.202105523
原文阅读,请扫描下方二维码

五. Gut Microbes | 代谢组+16S共同揭示饮食促进抗生素耐药基因在小鼠肠道菌群中的传播

饮食不仅可以为肠道菌群提供营养,还可以重塑它们。然而,饮食是否以及如何影响肠道微生物群中抗生素抗性基因 (ARG) 的传播尚不清楚。本研究通过给小鼠饲喂不同饮食并引入抗生素耐药菌,探索饮食对ARGs在肠道菌群中的传播的影响。
1. 与正常饮食相比,高糖、高脂、高蛋白饮食促进外源性ARGs在肠道菌群中的扩增和转移,上调trfAp和trbBp的表达;
2. 代谢组学结果表明,与正常饮食相比,高糖、高脂、高蛋白饮食显著改变肠道菌群及其代谢物。炎症相关产物与ARGs的传播密切相关,表明饮食重塑后的肠道微环境可能有利于ARGs的传播。这可能归因于饮食引起的炎症引起的细菌膜通透性、SOS 反应以及细菌组成和多样性的变化;
3. 流式细胞仪筛选的受体菌多为变形菌门、厚壁菌门和放线菌门,且大部分来源于饮食重塑的优势肠道细菌,表明ARGs的转移与饮食密切相关,具有一定的选择性;
4. 宏基因组学结果表明,肠道耐药基因组不仅会受到饮食的影响,还会受到外源抗生素耐药菌 (ARB) 的影响。当抗性基因选择受体细菌时,尽管它们可能对密切相关的细菌或环境中的优势细菌具有选择性,但可能无法区分共生细菌和病原细菌。因为它们处于同一生态位,它们可能会接受 ARGs 并成为 ARB,从而抑制抗生素治疗并对人类健康构成严重威胁。

High-sugar, high-fat, and high-protein diets promote antibiotic resistance gene spreading in the mouse intestinal microbiota. Gut Microbes. 2022.https://doi.org/10.1080/19490976.2021.2022442
原文阅读,请扫描下方二维码

六. Nature Communications丨母体肠道菌群代谢物调节新生儿胆道疾病

新生儿获得来自母体的肠道微生物组,形成了一个持久的生物足迹。有报道显示抗生素治疗后的孕鼠当其肠道富含产丁酸菌时,新生鼠对于黄疸具有显著的拮抗作用,提示母亲的肠道菌群可能影响新生儿胆道疾病的发生。本研究探讨了母亲肠道菌群代谢对新生儿胆管疾病易感性之间的关系,发现孕鼠富含产丁酸的厚壁菌门和拟杆菌门、谷氨酰胺代谢使得新生鼠对实验性胆道闭锁(BA)产生抗性。
1. 给孕鼠喂养丁酸盐,可抑制感染恒河猴轮状病毒(RRV)新生鼠自然杀伤(NK)细胞等免疫细胞的激活,从而改善感染导致的BA和肝脏损伤的症状;
2. 分析分娩鼠和感染RRV病毒的新生鼠的粪便微生物组,发现抗BA的后代与丁酸盐喂养的孕鼠肠道菌群相似,富含厚壁菌门和拟杆菌门等产丁酸菌;
3. 代谢组学分析显示,BA拮抗新生鼠粪便上清中次黄嘌呤和谷氨酸的丰度显著升高,其相关分子肌苷和谷氨酰胺的变化幅度较小,从而提高了它们在新生鼠中抑制免疫介导的胆管损伤中效应作用的潜力;
4. 人类BA新生儿粪便菌群中次黄嘌呤增加,谷氨酰胺显著降低;进一步的机制研究显示,谷氨酰胺可以促进胆管上皮细胞抵抗自然杀伤细胞(NK细胞)的细胞毒性。
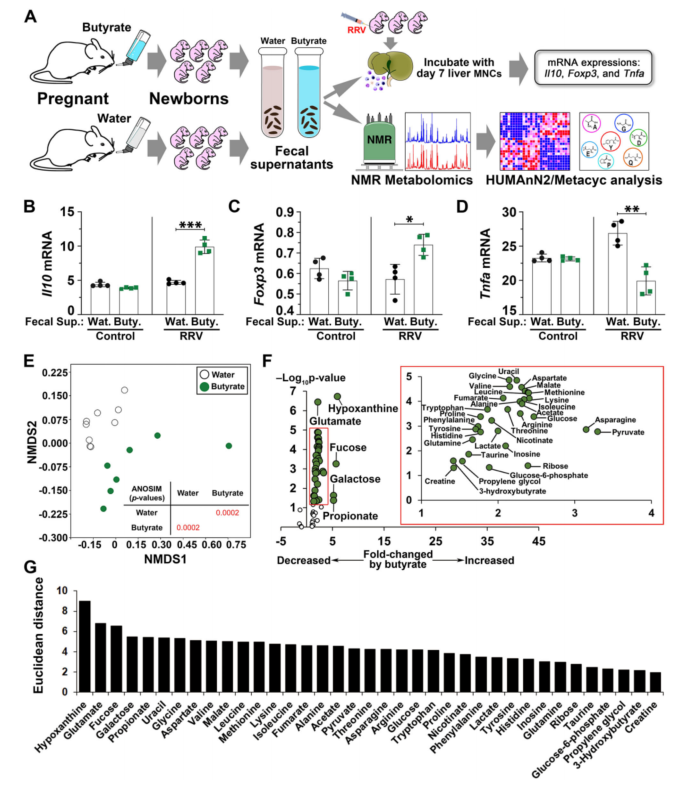
【图】小鼠的粪便代谢物抑制活化的免疫细胞,并富含次黄嘌呤/肌苷和谷氨酸/谷氨酰胺
Maternal regulation of biliary disease in neonates via gut microbial metabolites. Nature Communications. 2022. https://doi.org/10.1038/s41467-021-27689-4
原文阅读,请扫描下方二维码

七. Nature Communications | 肠道微生物通过调节胆汁酸组成和胆汁胆固醇分泌促进胆固醇结石形成

胆固醇胆结石病(GS)是一种世界性的常见病。胆囊中胆固醇过饱和胆汁的形成是其发病机制的前提。据报道,代谢性疾病(如肥胖、糖尿病等)等非遗传危险因素与胆结石的形成密切相关。有研究表明,感染肝内幽门螺杆菌的小鼠可促进胆固醇结石的发生。然而,目前还缺乏足够的证据来探讨肠道菌群促进胆结石形成的机制。本研究通过体内外菌群及代谢研究,阐明肠道微生物调节胆汁酸组成和胆汁胆固醇分泌促进胆固醇结石形成。
1. 首先发现了胆固醇GS患者和胆结石易感小鼠的粪便中富含脱硫弧菌(Desulfovibrionales)。通过胆石症患者的粪便微生物群移植(FMT)或与胆石症易感小鼠共饲养,可在胆结石症抗性小鼠中诱导胆结石形成;
2. 进一步发现富含脱硫弧菌的肠道微生物区系能够调节胆汁酸的分布,使其更加疏水性。脱硫弧菌产生的H2S有利于7α脱羟基菌的生长。从而增强的盲肠次级胆汁酸产生;
3. 同时脱硫弧菌产生的H2S可增强HepG2细胞FXR的表达并抑制CYP7A1的表达,进而调控胆汁酸代谢;
4. 携带脱硫弧菌的小鼠的血清和肝脏胆固醇水平显著升高,肝脏胆汁酸合成基因Cyp7a1、Cyp8b1、Cyp27和Cyp2c70的表达受到抑制,胆固醇转运蛋白Abcg5、Abcg8等表达升高,从而以促进胆固醇的分泌。
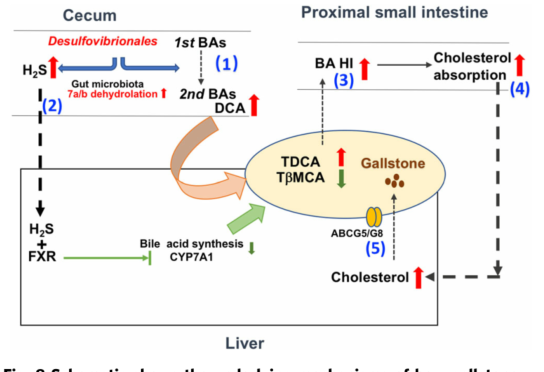
Gut microbiota promotes cholesterol gallstone formation by modulating bile acid composition and biliary cholesterol secretion. Nature Communications. 2022. doi: 10.1038/s41467-021-27758-8.
原文阅读,请扫描下方二维码

八. Gut | 肠道微生物群通过 PUFA 相关的神经炎症调节阿尔茨海默症的病理和认知障碍

慢性炎症在AD(阿尔茨海默症)发病机制中起着关键作用,激活的小胶质细胞和神经炎症与AD患者的认知能力下降相关。肠道菌群失衡可导致小胶质细胞释放促炎细胞因子并促进神经炎症反应。但肠道菌群失调对AD发病机制的贡献仍不清楚。本研究通过体内外实验发现以拟杆菌属富集为特征的肠道菌群可通过激活C/EBPβ/AEP通路,上调促炎症性的多不饱和脂肪酸(PUFA)代谢,以增强小神经胶质细胞活化及神经炎症。
1. 不同年龄3×Tg小鼠的微生物16S rRNA测序结果表明,老年鼠拟杆菌属富集。与SPF(无特定病原体)小鼠相比,GF(无菌)3xTg小鼠的脑淀粉样蛋白-β斑块和神经原纤维缠结病理学显著减少,同时GF 3xTg小鼠C/EBPβ/AEP通路和AA相关炎症反应减弱;
2. 海马组织的RNA测序结果显示在肠道无菌情况下,3xTg 小鼠大脑中的炎症通路和胰岛素/IGF-1信号传导发生异常改变;
3. 与对照组GF小鼠相比,SCFA喂食的GF小鼠的小胶质细胞活化和成熟形态增加。代谢组学分析结果表明,与SPF小鼠相比,GF 3×Tg小鼠大脑中与AA相关的代谢物(PGE2- G 等)减少;
4. SCFAs引发GF 3×Tg小鼠C/EBPβ/AEP激活、认知障碍和炎症,AA-代谢物PGE2- G加重炎症。与健康供体微生物群移植相比,AD患者的肠道微生物组加剧了3xTg小鼠的AD病理,与C/EBPβ/天冬酰胺内肽酶通路激活和认知功能障碍有关。
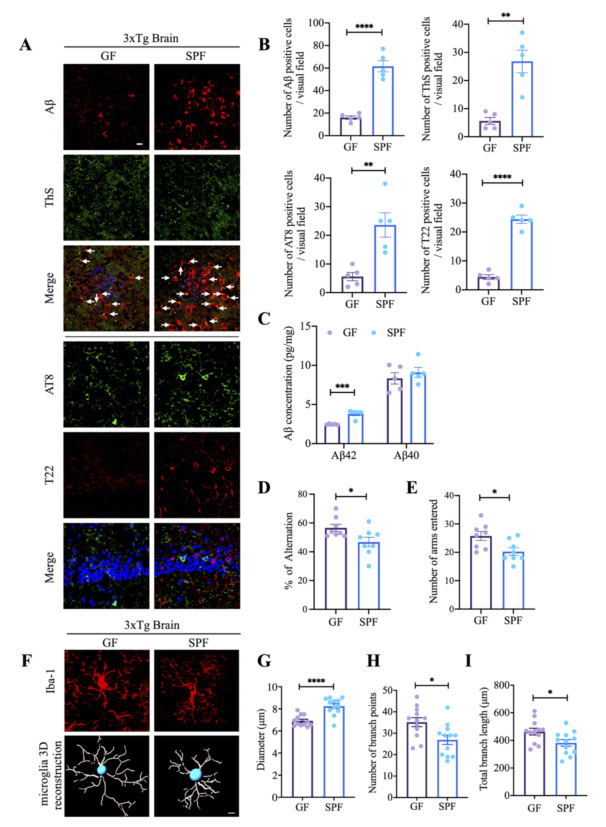
Gut microbiota regulate Alzheimer’s disease pathologies and cognitive disorders via PUFA-associated neuroinflammation. Gut. 2022. doi: 10.1136/gutjnl-2021-326269.
原文阅读,请扫描下方二维码

往期推荐
地 址: 上海市浦东新区秀浦路2555号康桥商务绿洲E6栋5层 联系人: 林景超 电 话: 400-867-2686 传 真: 021-20900216 Email:marketing@metaboprofile.com
麦特绘谱生物科技(上海)有限公司
商家主页
