
期刊:Neuro-Oncology
主要技术:snRNA-seq、ST RNA-seq、bulk RNA-seq
导语
脊索瘤是一种罕见且局部侵袭性的间叶性肿瘤,源于原始脊索残余,好发于骶骨和颅底区域,对传统化疗不敏感,目前最佳治疗是手术切除联合辅助放疗,但因肿瘤的浸润性及靠近关键神经血管结构,根治性切除有挑战,术后易复发或转移。癌相关成纤维细胞(CAFs)是基质中的主要细胞类型,其密度与许多恶性肿瘤的侵袭、转移和不良预后相关,在脊索瘤中,基质成分与肿瘤侵袭表型、患者生存和免疫反应有关,但CAFs对脊索瘤发展和进展的影响尚不清楚。本研究利用scRNA - seq(n=9)、ST RNA-seq(n=3)、bulk RNA-seq(n=128)和QIF(n=105)来确定脊索瘤中CAFs的细胞类型、空间分布和临床意义,首先通过scRNA - seq对CAFs进行综合表型研究,然后用多模态交叉分析将scRNA - seq的CAFs图谱与ST数据整合,最后用bulk RNA - seq和QIF验证观察结果,有助于更好地理解CAFs在脊索瘤进展中的生物学功能,并为开发新的治疗策略提供思路。
技术服务
snRNA-seq、ST RNA-seq、bulk RNA-seq
研究结果
1. 单细胞转录组识别脊索瘤图谱
对6名脊索瘤患者(3名原发、3名复发)以及3名髓核(NP)进行单细胞测序。共获得72097个细胞,其中46987个来自脊索瘤,25110个来NP组织。识别出49个细胞群,通过marker基因可分为上皮样细胞、单核吞噬细胞、T细胞、内皮细胞、中性粒细胞、B细胞、破骨细胞、成纤维细胞、软骨细胞和壁细胞10种类型(图1A-E)。上皮样细胞、成纤维细胞、T细胞和B细胞属于多个群,表明这些细胞类型具有异质性(图1A)。与NP组织相比,脊索瘤组织中上皮样细胞较多,尤其是复发性肿瘤(图1C)。通过inferCNV分析、及细胞周期分析表明上皮样细胞具有显著高的拷贝数变异(CNV)水平并处于增值状态,综合这些结果表明上皮样细胞代表肿瘤细胞。
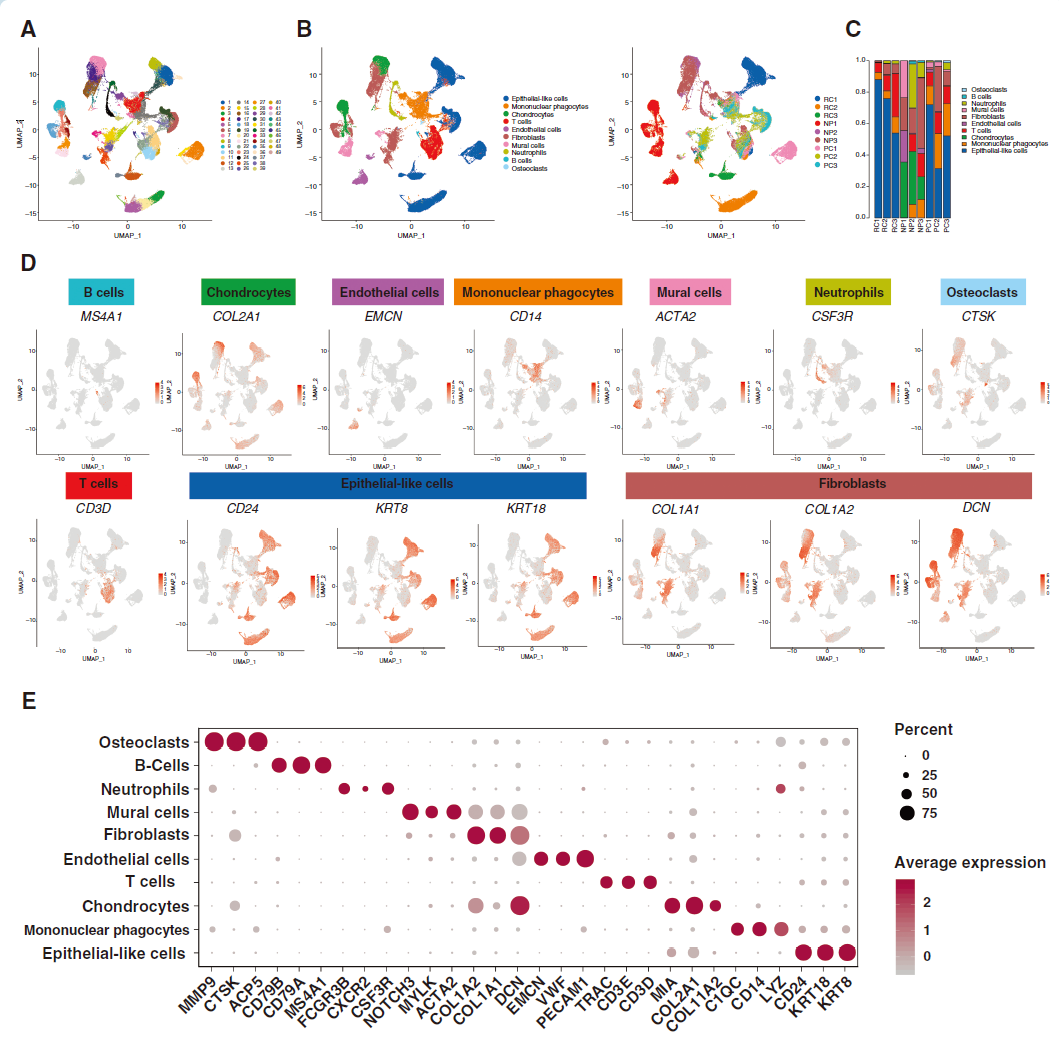
图 1
2. 脊索瘤微环境中功能独特的CAF群体识别
为进一步研究成纤维细胞,研究人员对其进行亚群的细分,基于特定细胞标志物确定了 6个主要的成纤维细胞亚群(图2A-B)。用热图展示各群中前10个差异表达基因(DEGs)的表达水平来可视化6个癌相关成纤维细胞(CAF)亚群间的关键差异(图2C)。其中,成纤维细胞 - 1 和 - 5仅在脊索瘤中观察到,提示它们是脊索瘤特异性 CAFs(图2D)。比较分析表明 CAFs、癌细胞和正常成纤维细胞在干性和细胞周期分数上无显著差异(图 2E),功能富集分析显示CAFs与成纤维细胞和癌细胞有共同活动(图2F)。在转录组水平,CAFs 高表达成纤维细胞(如COL1A1和COL6A1)和肿瘤细胞(如SPP1和RARRES21)的标志物基因(图2G)。
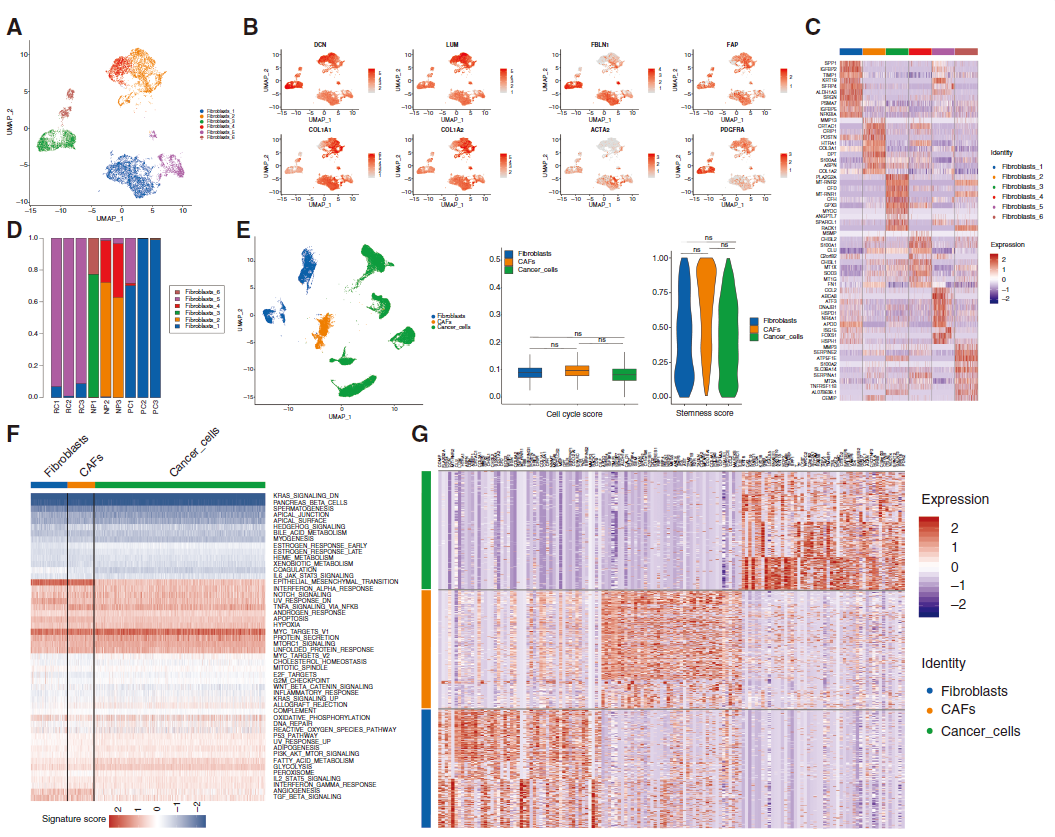
图 2
3. 成纤维细胞聚集揭示与脊索瘤进展相关的独特亚群
为识别CAF亚群并阐明其功能,研究人员对脊索瘤组织中的所有CAFs(成纤维细胞 - 1和 - 5细胞)进行了降维分析。确定了4个CAF亚群,其中CAF - 1和CAF - 2为主要亚型(图3A),它们都高表达CAFs的特定marker基因,如POSTN、THY1、ACTA2等(图3B),同时展示4个CAF群之间的基因表达差异(图3C)。分析CAF亚群的起源,发现CAF-2存在于复发性肿瘤中,CAF-3和CAF-4存在于原发性肿瘤组织中,CAF-1在两种肿瘤组织中均存在(图3D)。基于GO富集分析,CAF-2与内质网应激(ERS)反应相关,其特征是高表达ERS相关和缺氧基因(HSPA1A、HSPA1B、CCL2等);CAF-1与能量代谢相关,高表达SPP1、RBP4、AGT等;CAF-3与中性粒细胞激活有关,表达MMP9、ACP5、CKB等;CAF-4主要促进骨骼系统发育,表达IBSP、IFITM5、DLX5等(图3E-I)。CAF-4也高表达缺氧和ERS相关基因,但功能富集分析未显示CAF-4与ERS反应有关。综合结果表明,只有CAF-2可能参与ERS过程。由于CAF-2仅存在于复发性肿瘤组织中,且ERS和缺氧信号通路的异常激活是肿瘤进展的关键调节因素,推测CAF-2可能与脊索瘤进展有关。
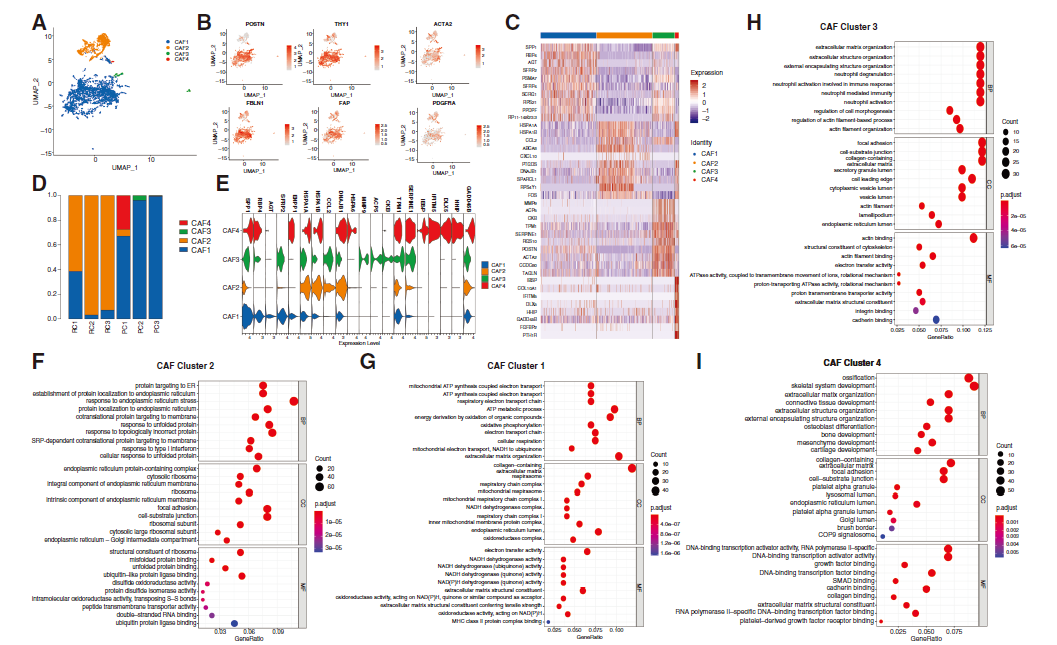
图 3
4. GSVA表明ERS-CAF特征评分与脊索瘤进展相关
为验证ERS - CAF的促肿瘤作用,研究人员对126例脊索瘤患者样本进行bulk RNA - seq(图4A)。用代表该CAF子集的基因集(包括ERS相关基因如 HSPA1A、HSPA1B、CCL2、及CAF特异性标志物如THY1、FAP、COL1A1)计算每位患者的ERS - CAF特征评分;该评分与肿瘤侵及周围肌肉、肿瘤分级、AJCC分期、手术切缘显著相关,复发性肿瘤患者评分略高但差异不显著(图4B)。通过在线平台确定阈值将患者分组进行生存分析,Kaplan - Meier分析显示评分升高预示不良的无局部复发生存率(LRFS)和总生存率(OS)(图4C),在Cox多元回归模型控制重要临床因素后仍显著(图4D - E)。
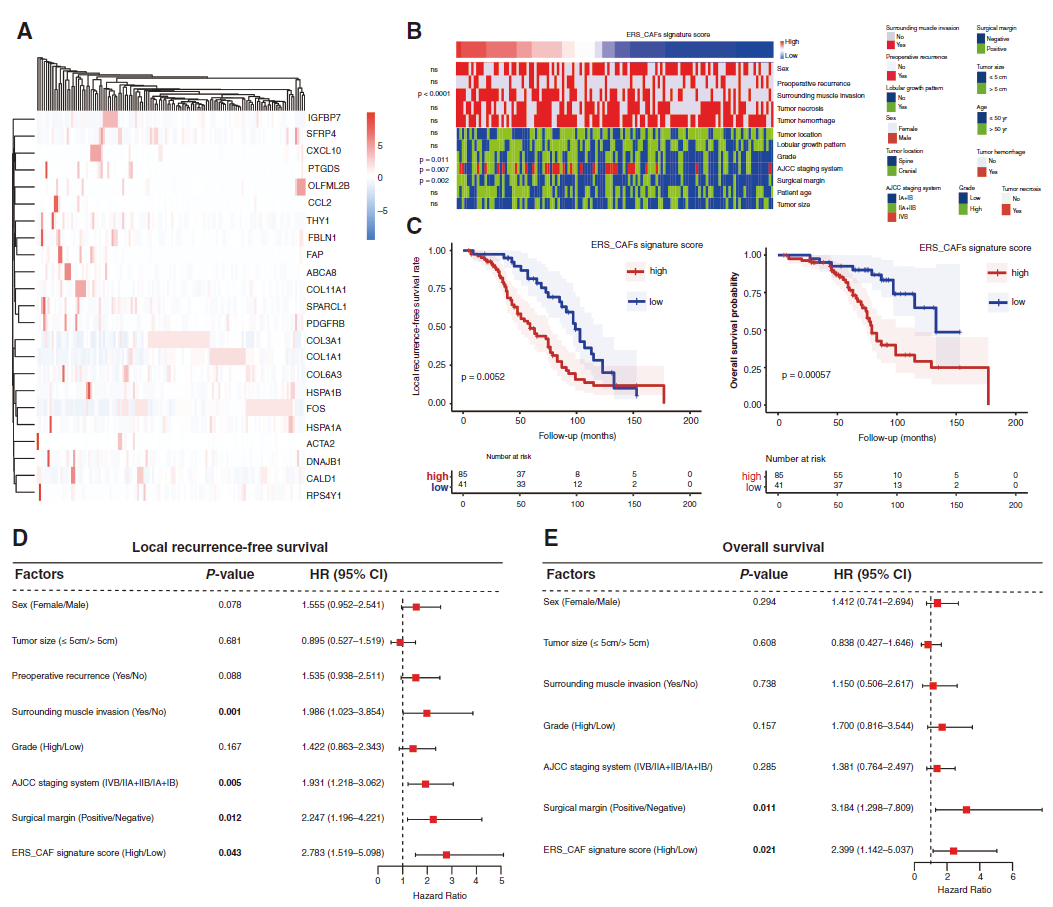
图 4
5. ERS-CAF可能从不同方面促进脊索瘤进展
为推断ERS - CAF亚群促进肿瘤进展的可能机制,研究人员进一步分析CAF亚群与其他细胞类型的细胞间通讯。结果显示CAF亚群(尤其是ERS - CAFs和CAF-1)显著激活并与多种细胞相互作用(图5A-B),确定许多配体-受体对展示ERS - CAF与脊索瘤主要细胞类型间的广泛分子相互作用。对于传入信号,ERS - CAFs主要接受来自CD46、EFG、SELL等分子的信号;对于传出信号,主要产生TENASCIN、IGF、LIFR等信号(图5D),且ERS - CAFs是几个细胞通讯网络(包括JAM、THBS和GDF信号通路)的核心细胞(图5E)。对10个肿瘤组织样本进行QIF分析进一步证实ERS - CAF和肿瘤细胞间JAM2和JAM3的交互信号,发现肿瘤细胞靠近ERS - CAF的区域JAM2/JAM3信号表达更强,表明ERS- CAFs可通过多种分子机制促进脊索瘤进展。
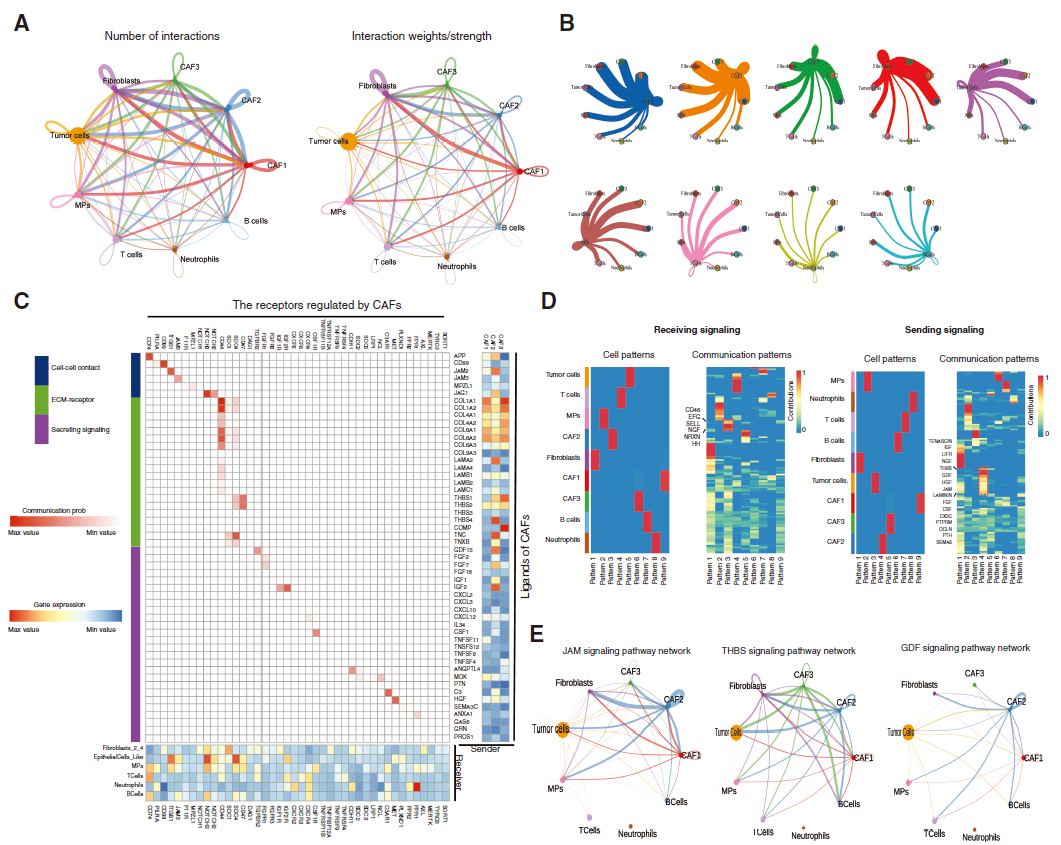
图 5
6. ERS-CAF与其他细胞类型的空间关系
为进一步剖析脊索瘤组织中ERS - CAF的空间特征,对3个新鲜肿瘤样本(图6A、 G)进行了空间转录组测序。在ST数据中观察到UMIs与标记基因之间有很强的相关性(图 6B 、H),表明质量良好。在ST数据中检测到上皮样细胞(KRT8)、单核吞噬细胞(CD14)、T 细胞(CD3D)、内皮细胞(PECAM1)、中性粒细胞(CSF3R)、B 细胞(CD79A)、成纤维细胞(COL2A1)和壁细胞(ACTA2)的标记基因(图6C 、 I)。随后,通过UMAP方法降维在原发性和复发性肿瘤样本中均确定了8个主要细胞群(图6D、J)。在原发性肿瘤中观察到CAF-1,而在复发性肿瘤样本中同时观察到CAF-1和ERS - CAF(图 6D 、 J)。通过CAF标记基因的基因表达分析(图 6E 、K)和MIA结果(图 6F 、 L)证实了这些发现。使用邻域得分和接近度得分来表征每个 ERS - CAF 位点周围的细胞类型组成。分析显示ERS - CAF与肿瘤细胞之间具有高邻域得分和接近度得分,表明这两种细胞类型之间有很高的相互作用概率。此外,对ST数据的stLearn分析表明ERS - CAF与脊索瘤细胞之间存在相互作用。
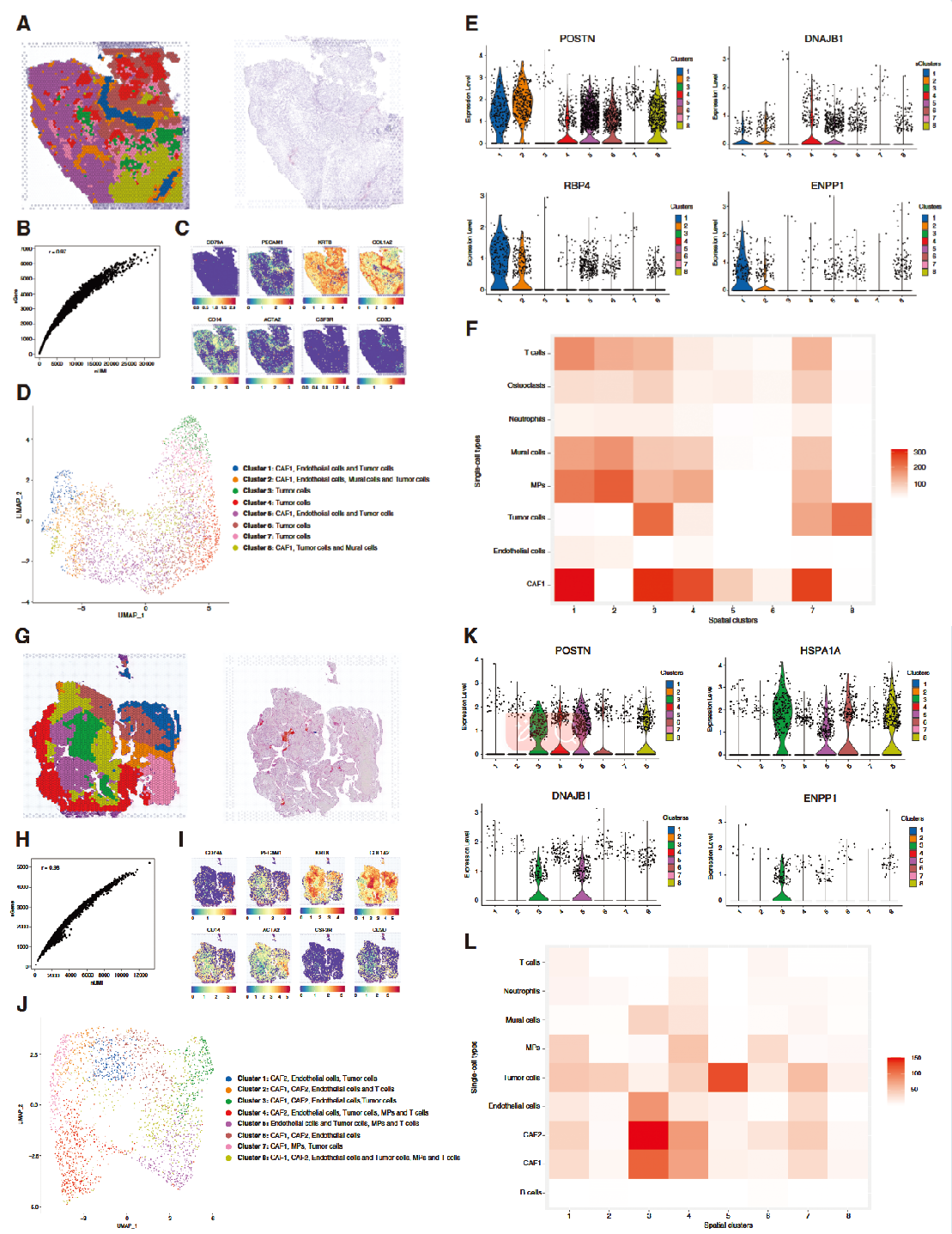
图 6
结论
对3个原发性和3个复发性肿瘤样本以及3个髓核样本作为对照的72 097个单细胞进行了测序。在复发性肿瘤中发现了一个独特的CAF群,该群高度表达缺氧基因并在内质网应激 (ERS) 中功能性富集。拟时间轨迹和细胞通讯分析表明,该ERS-CAF亚群起源于正常成纤维细胞,并与肿瘤和免疫细胞广泛相互作用。通过分析126名患者的bulk RNA-seq 数据,研究人员发现,ERS-CAF特征评分与脊索瘤的侵袭和不良预后有关。通过将 scRNA-seq 的结果与空间转录组学相结合,证明了ERS-CAF在脊索瘤组织中的存在,并揭示了这种CAF 亚型与周围肿瘤细胞的距离最接近。在随后涉及105名另外患者的QIF验证中,证实 ERS-CAF在脊索瘤微环境中丰富且靠近肿瘤细胞。此外,ERS-CAF 密度及其与肿瘤细胞的距离都与肿瘤恶性表型和不良患者结果相关。
参考文献:
Zhang TL, Xia C, Zheng BW, et al. Integrating single-cell and spatial transcriptomics reveals endoplasmic reticulum stress-related CAF subpopulations associated with chordoma progression. Neuro Oncol. 2024 Feb 2;26(2):295-308. doi: 10.1093/neuonc/noad173. PMID: 37772937; PMCID: PMC10836767.
