
阿尔茨海默症中的野生型Tau蛋白
译自Stressmarq 博客-BRENDA KNOX | 文献综述
由MAPT 基因编码的微管相关tau蛋白主要在神经元中表达,该蛋白以六种352-441 个长度不等的氨基酸单体异构体形式存在1。 在正常情况下,tau单体在稳定神经元微管和调节轴突运输方面发挥着重要作用。但是在病理条件下,tau单体与神经元微管的分离导致细胞内聚集体的形成,导致神经元细胞死亡。迄今为止,tau病变引起的病症有20多种,阿尔茨海默病是最普遍的。其中大概10%是由 MAPT 基因的显性突变引起的,统称为额颞痴呆与17号染色体相关的帕金森综合征 (FTDP-17),尽管最近有人提议停用该名称2,3。其余的偶尔发生和涉及是野生型 tau蛋白2。
野生型tau蛋白是如何在偶发性的神经退行性疾病中发挥作用的?
在病理条件下,野生型tau单体过度磷酸化并与带负电荷的神经元微管分离,然后蛋白发生错误折叠和构象改变,在细胞质中积累并触发纤维生成——低聚物的自发形成,可以纤维化成细胞内成对螺旋丝(PHF)和神经纤维缠结(NFTs)4。Tau寡聚体、PHF和NFTs都可以分泌并传递到邻近细胞,在那进一步寡聚或聚集,最终发展成阿尔茨海默。虽然NFTs一直被认为是tau蛋白疾病认知障碍的主要原因(例如,NFT的数量与阿尔茨海默病的痴呆程度相关),但最近有研究表明,tau寡聚体才是主要的有毒tau蛋白4,5。
突变的tau蛋白原纤维是如何影响野生型tau蛋白单体的?
MAPT基因的致病突变通常会影响tau编码序列,致使单个氨基酸的改变影响蛋白质的初级结构。根据它们发生的确切位置,这种突变会增强tau蛋白的聚集。为了研究特定tau蛋白突变在疾病发病机制中的作用,实验设置比较不同重组tau蛋白突变体形成原纤原的情况,其中G272V和P301L突变均能显著增加蛋白丝延伸的效率6。此外,利用P301L/V3.37M突变原纤维对野生型tau单体的聚集进行了聚集实验,发现这些原纤维可以产生一种新的纤维构象,并且在多种聚集反应实验中都是如此2。
野生型Tau蛋白在疾病模型中扮演什么样的角色?
野生型tau蛋白以多种不同的方式揭示了阿尔茨海默病等变性疾病的奥秘。最常见的方式包括重组的过表达tau蛋白确定其对正常生理过程的影响,以及比较不同tau蛋白亚型的聚集能力从而发现它们是如何参与疾病的发生和发展的。由于大多数tau蛋白疾病是偶发的,了解更多野生型tau对开发有效的治疗方法至关重要。
Tau蛋白疾病的研究相关的产品
StressMarq能够提供多种试剂用于研究tau蛋白及其在神经退行性疾病中的作用。其中包括Tau441 (2N4R)野生型单体(SPR -479),它可以与Tau441 (2N4R)野生型预制原纤维(SPR-480)结合,用于研究体外tau蛋白聚集。我们也提供野生型截短Tau片段(AA297-391) (dGAE)前体原纤维(SPR-461)和伴随截短Tau片段(AA297-391) (dGAE)单体(SPR-444)用于聚集研究。欲了解更多关于Tau蛋白的信息,包括所有Tau蛋白纤维化蛋白的列表和关于Tau蛋白PFFs的短视频,请访问我们专门针对Tau蛋白的网页。
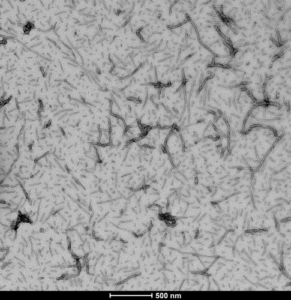
重组人 Tau441 (2N4R)的电镜图, 野生型前体原纤维(SPR-480)
详情请咨询StressMarq全国授权一级代理-欣博盛生物科技
全国服务热线: 4006-800-892 邮箱: market@neobioscience.com
深圳: 0755-26755892 北京: 010-88594029 上海: 021-34613729
广州: 020-87615159 香港: 852-69410778
代理品牌网站: www.nbs-bio.com
自主品牌网站: www.neobioscience.net
