
发表期刊:Food&Function
发表时间:2021年10月
影响因子:5.396
合作客户:陕西科技大学,渭南师范学院
研究背景
糖尿病(DM)是一种由糖脂代谢紊乱引起的慢性高血糖为特征的代谢性疾病。据国际糖尿病联合会报告,2020年全球有4.6亿人受到糖尿病的影响,使糖尿病成为继癌症和心血管疾病之后威胁人类健康的第三大慢性疾病。糖尿病患者中2型糖尿病占糖尿病病例的90%。不健康的饮食习惯、肥胖和遗传是T2DM的主要诱因,最终导致胰岛β细胞功能受损。目前,糖尿病治疗主要是长期注射外源性胰岛素和口服降糖药物,包括磺酰脲类、双胍类等,并辅以饮食控制和适当运动来维持血糖水平。这些药物存在一定的负面作用,所以急需寻找其他低毒、高效的降糖方法来辅助糖尿病治疗或缓解其症状。
研究思路及结果
本文利用代谢组学分析阐述黑木耳多糖(AAPs)对链脲佐菌素诱导的2型糖尿病(T2DM)小鼠的降糖作用。通过对小鼠的空腹血糖、口服糖耐量试验、空腹血清胰岛素水平、胰岛素抵抗指数、TC、TG、HDL-C、LDL-C及组织病理学观察记录,并使用AAP处理小鼠,对处理前后小鼠的血清中差异代谢物进行分析。结果阐明了AAPs在缓解T2DM中的代谢途径,为开发治疗T2DM的功能性食品佐剂提供了指导。
1.AAPs对小鼠体重、摄食量和饮水量的影响
通过对各组小鼠的体重变化趋势观察分析,试验前各组间无显著差异(P> 0.05),在HFD开始后除了NC组外,各组体重迅速增加。体重减轻是糖尿病的典型症状,T2DM小鼠在干预期间体重逐渐下降(超过6-10周),相应的体重下降了近20%。但是在AAP和二甲双.胍的干预下,T2DM小鼠的体重保持稳定。最终AAP-M组小鼠的体重显著高于MD组(P< 0.05)。在成功诱导2型糖尿病后,T2DM小鼠出现更多的饮食症状,特别是糖尿病小鼠的饮水量显著高于正常小鼠(P< 0.01)。AAP干预后,小鼠的平均饮食量和饮水量均有不同程度的下降。
2.AAPs对FBG水平和OGTT值的影响
空腹及餐后血糖升高是糖尿病诊断的主要标准。在实验开始时,各组FBG初始水平均在正常范围内,STZ诱导后的T2DM小鼠FBG水平显著高于11.1 mmol L−1(P< 0.01),提示高血糖模型建立成功。在AAP和二甲双.胍干预第5周,小鼠的NC和AAP治疗组的FBG水平显著低于MD组(P< 0.01),AAP-M组降糖效果最佳,较AAP-L、AAP-H、PC组降糖效果显著降低42% (P< 0.01)。
口服葡萄糖耐量试验(OGTT)广泛应用于糖尿病的诊断。正常和T2DM小鼠在口服2.0g/kg b.w葡萄糖30min后,所有小鼠的血糖均达到最大值,随着时间的延长,各组血糖均逐渐降低。在整个实验过程中,正常小鼠的血糖水平明显低于T2DM小鼠(P< 0.01)。这是由于stz诱导胰岛β细胞损伤,导致血糖调节能力严重不足。AAP-M组在120min时血糖水平为14.17±1.56 mmol L−1,显著低于其他各组(P< 0.01)。因此,补充AAP可能会加速葡萄糖的消耗速度,从而产生降低血糖的效果。
3.AAPs对FINS水平、胰岛素抵抗指数稳态模型评估和血脂水平的影响
胰岛素是由胰岛β细胞分泌的一种激素,具有降低血糖的作用,是临床诊断和分型的参考指标。图1中分别显示了每组小鼠的FINS水平和稳态模型评估胰岛素抵抗指数(HOMA-IR)值,MD组FINS水平和HOMA-IR值均显著高于NC组(P< 0.01)。治疗5周后,与MD组相比,各治疗组FINS水平和HOMA-IR值均显著降低(P< 0.01)。
血清胰岛素水平升高在早期T2DM患者中非常常见。因此,AAPs对T2DM小鼠胰岛素拮抗具有一定的保护作用。流行病学研究表明,DM常伴有血脂异常,主要表现为TC、TG、LDL-C升高,HDL-C水平降低。如图1所示,与NC组比较,MD组TC、TG、LDL-C水平显著升高(P< 0.01), HDL-C水平显著降低(P< 0.01)。AAP组和二甲双.胍组小鼠的TC、TG、LDL-C水平均高于正常组,进一步证实T2DM小鼠血脂水平异常。AAP-L、PC组TG、TC显著低于MD组(P< 0.05)。因此,服用AAPs或二甲双.胍可以缓解TG和TC的升高。目前,血脂异常对T2DM病程的影响仍存在争议。尼日利亚的一项研究表明,糖尿病持续时间和血脂异常之间没有显著相关性(P> 0.05)。这些结果与当前结果之间的差异可能是由于血糖控制和使用的样本量、环境影响以及其他方面的差异造成的。
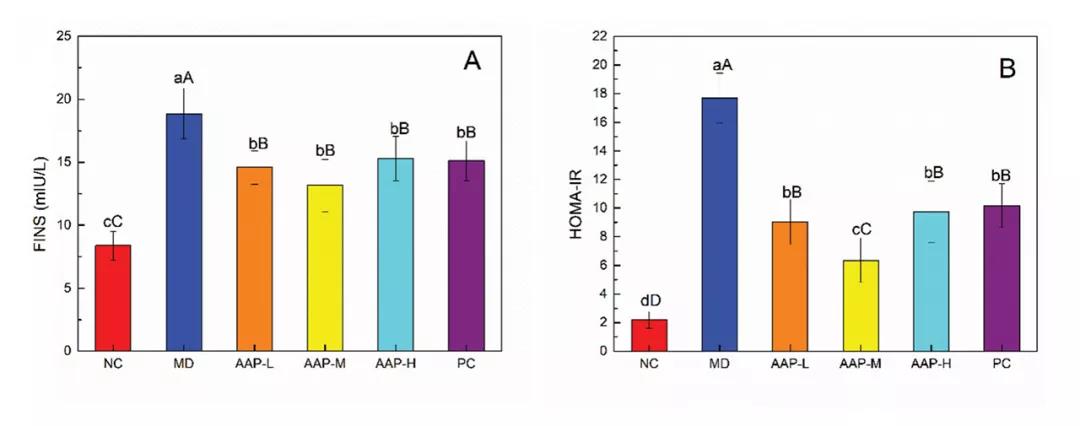
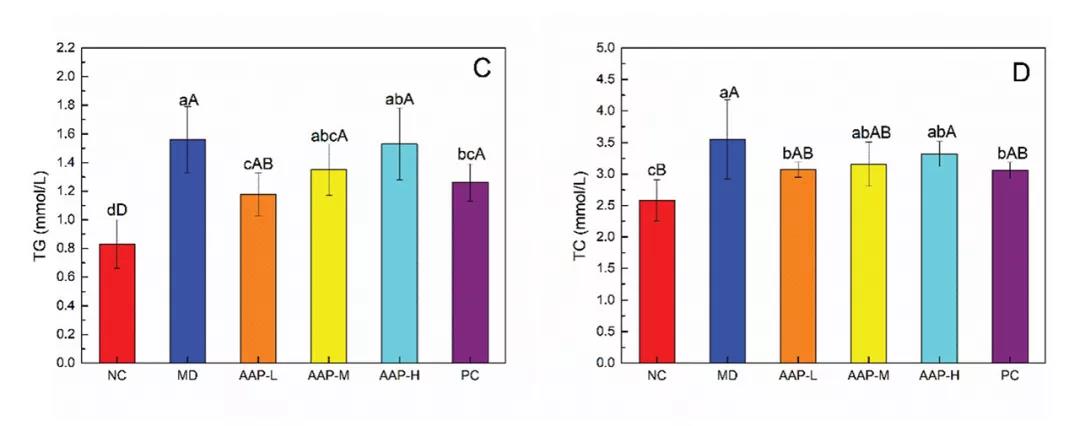
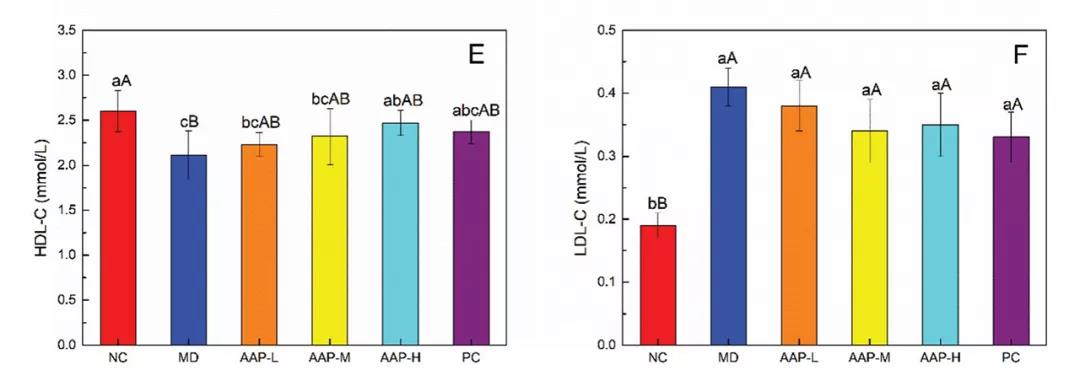
图1. AAPs对(A) FINS、(B) HOMA-IR、(C) TG、(D) TC、(E) HDL-C和(F) LDL-C水平的影响
4.AAPs对胰腺和肝脏组织病理学的影响
各组胰腺组织学变化见图2A-F。NC组胰岛细胞正常,细胞核清晰圆形,薄层纤维组织包膜相对完整,分叶状清晰,无增厚。未见炎症细胞浸润、增殖等明显病理改变(图2A)。MD组胰岛萎缩,形态不规则,部分胰岛细胞变性、坏死、空泡化;也观察到核固缩或溶解(图2B)。AAP和二甲双.胍可不同程度地修复胰腺组织损伤(图2C-F)。AAP-M和AAP-H组修复效果最明显:胰岛细胞形态相对正常(细胞核清晰,椭圆形规则),无明显炎症细胞浸润和增殖(图2D和E)。
肝细胞病理观察如图2a-f所示。NC组肝索排列整齐,中心静脉内皮细胞完整,肝细胞形态正常。肝细胞及小胆管内未见胆汁淤积,胆管结构完整清晰,无明显脂滴及炎性细胞浸润(图2a)。与此相反,MD组肝细胞胞浆中可见许多未染色的圆形脂滴;此外,肝细胞核肿胀,证实HFD导致部分肝细胞发生脂肪变性(图2b)。在不同的治疗组中,肝脏病变的数量显著减少。然而,在PC组(图2f)、AAP-L组(图2c)和AAP-H组(图2e)中,个别单个肝细胞胞浆中偶见空泡或脂滴。AAP-M组小鼠肝细胞形态正常,与NC组小鼠相似(图2d)。这些结果表明AAP (200mg/kg b.w)可以缓解T2DM引起的内脏病变。
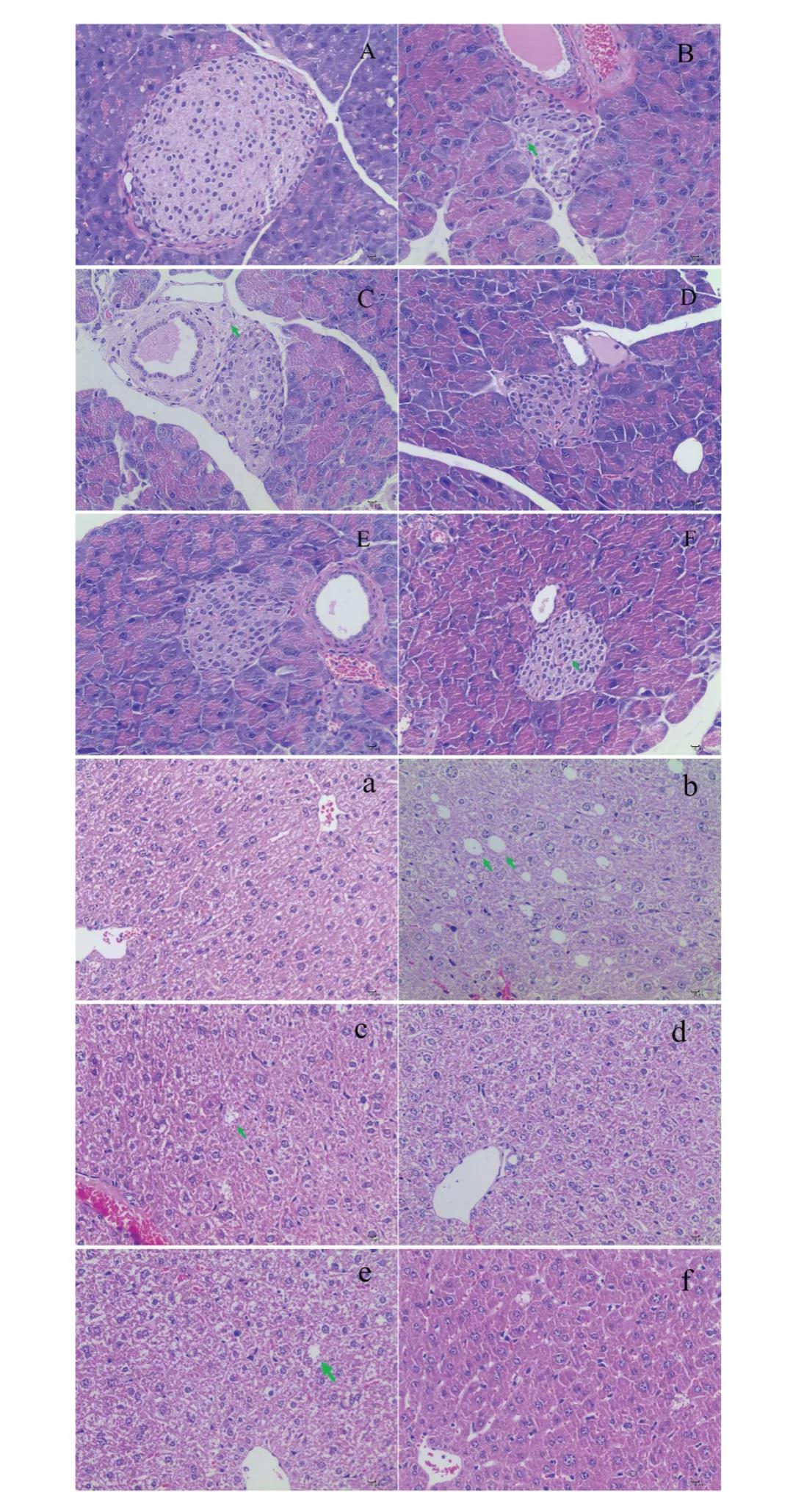
图2. AAPs对胰腺和肝脏组织病理影响
5.非靶向血清代谢组学分析
基于上述结果,AAP-M组改善缓解效果相对较好,选择NC和MD为研究对象,通过UHPLC-QE HFX-MS技术进行代谢物检测分析进一步探讨AAP对T2DM代谢通路的积极作用。在血清样本POS和NEG离子模式下的PCA图中,MD和AAP-M组均与NC组明显分离,表明T2DM模型建立成功(图3A-B)。因此,AAP给药200mg/kg b.w后小鼠的代谢物与MD组有显著差异。由于代谢数据具有复杂的多维特性,单靠无监督PCA模型分析无法很好地区分样本间的组间差异。因此,使用OPLS-DA进行数据分析,OPLS-DA得分图显示MD组和NC组在两种模式下的代谢谱明显分离,置换检验表明模型稳定可靠(图3)。PCA和OPLS-DA结果进一步证实了我们STZ诱导T2DM小鼠模型的成功建立,AAP-M给药可以调节小鼠的代谢谱。
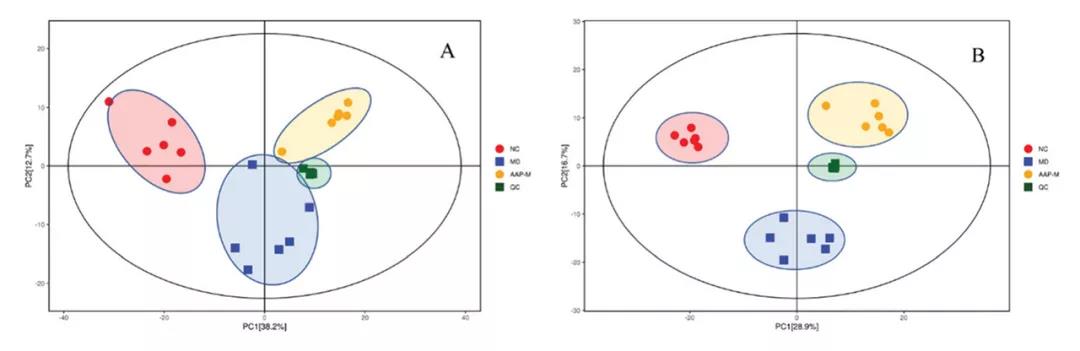
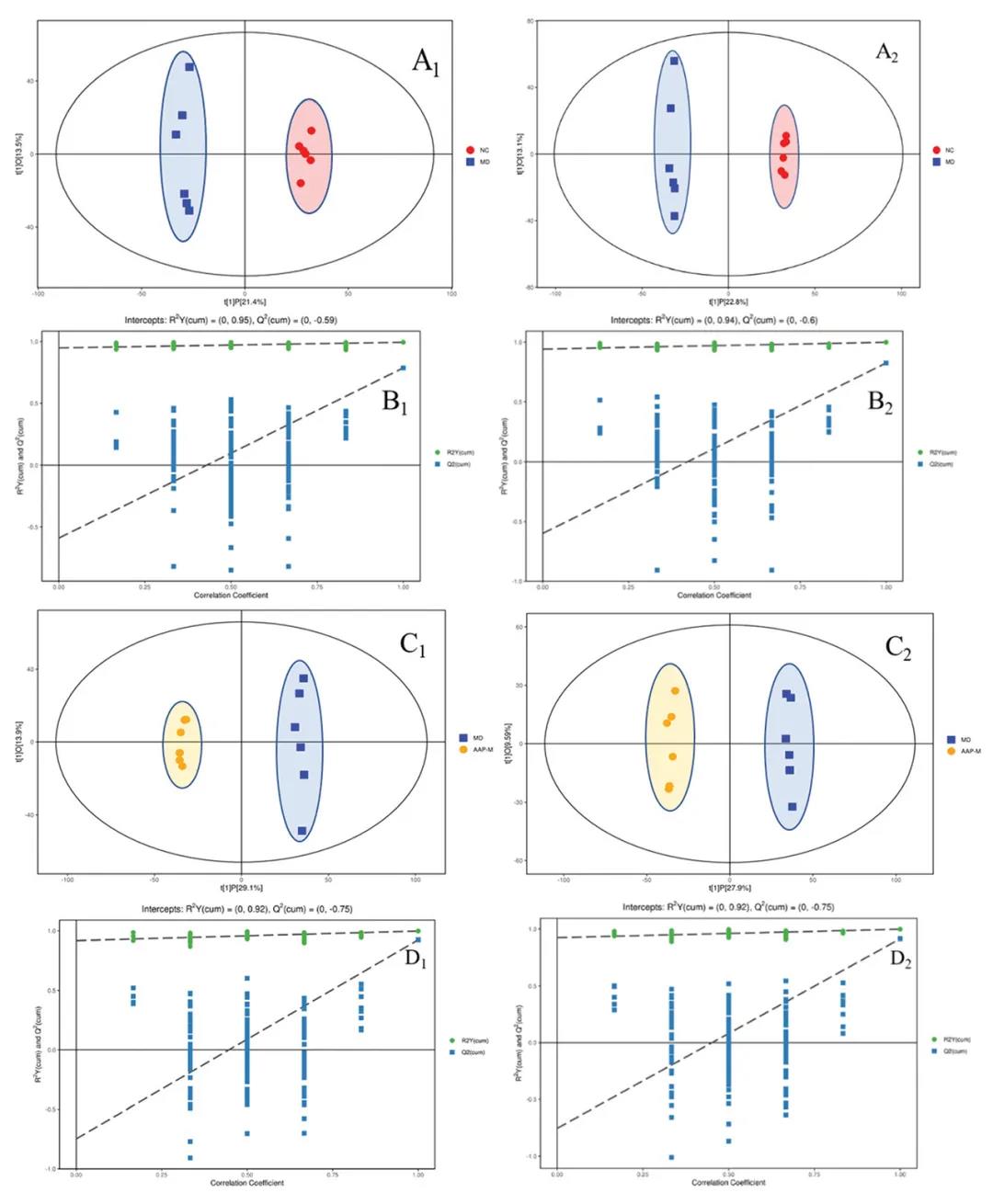
图3. POS和NEG离子模式的PCA和OPLS-DA
为了研究两组之间潜在的生物标志物,根据VIP>1且p<0.05筛选差异代谢物,火山图中,红色代表代谢物上调,蓝色代表代谢物下调。在MD组和NC组之间,共鉴定出134种代谢物,其中POS和NEG离子模式的代谢物分别为69和65种。在AAP-M和MD组之间,鉴定了179个代谢物,其中包括101个和78个在POS和NEG离子模式下的代谢物。据此筛选出45种最有可能成为潜在生物标志物的物质,代谢物水平较高的MD组比NC组包括胆固醇、L-gulose, dihydrothymine等,相比之下,低水平的MD组比NC组包括indole-3-carbi-nol,L-aspartic acid等。
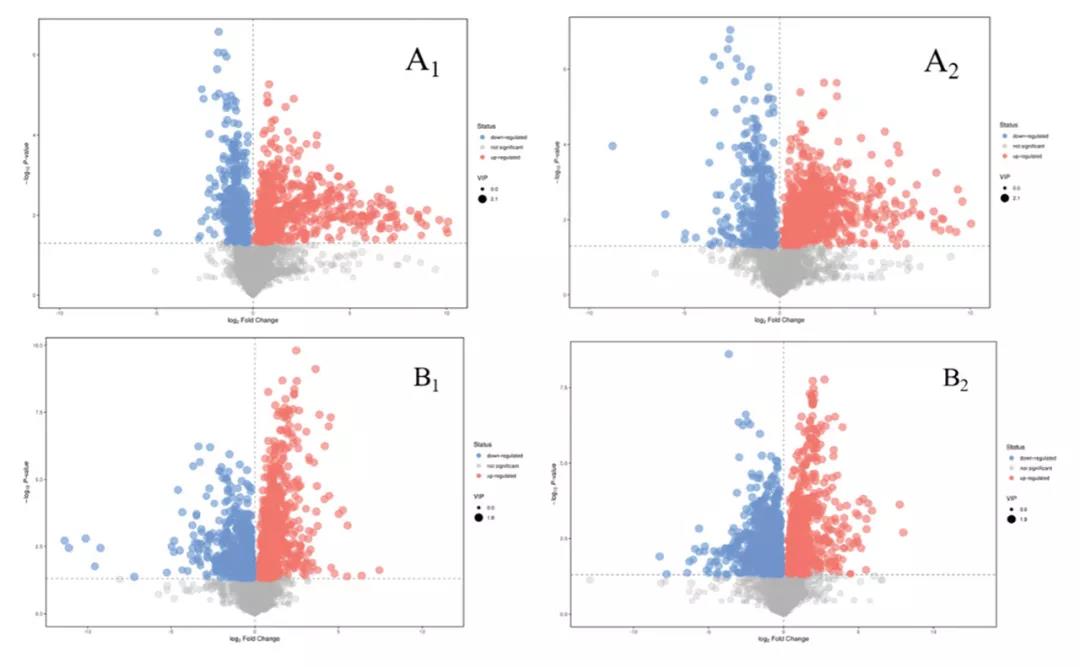
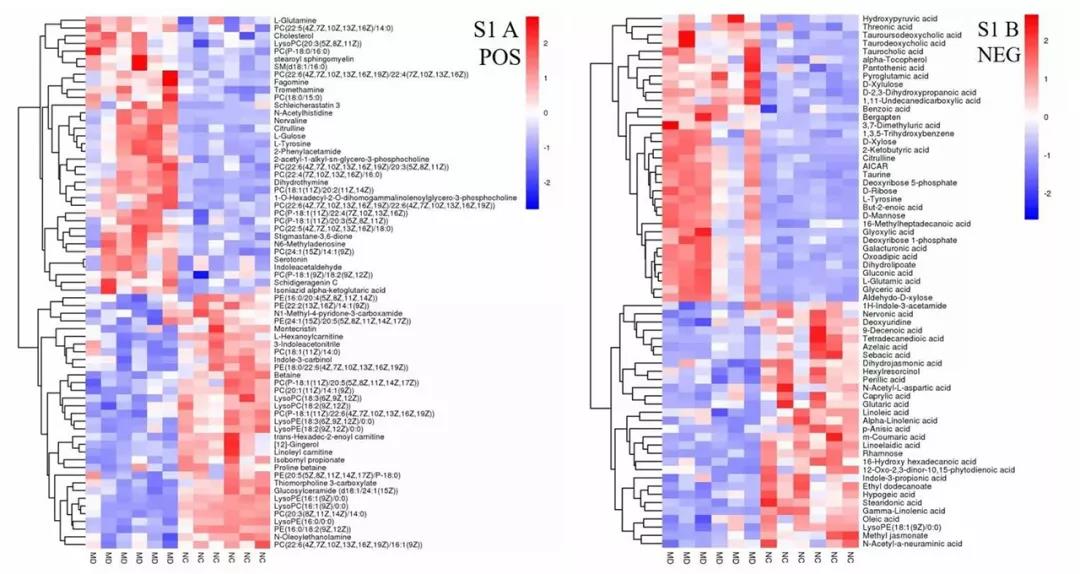
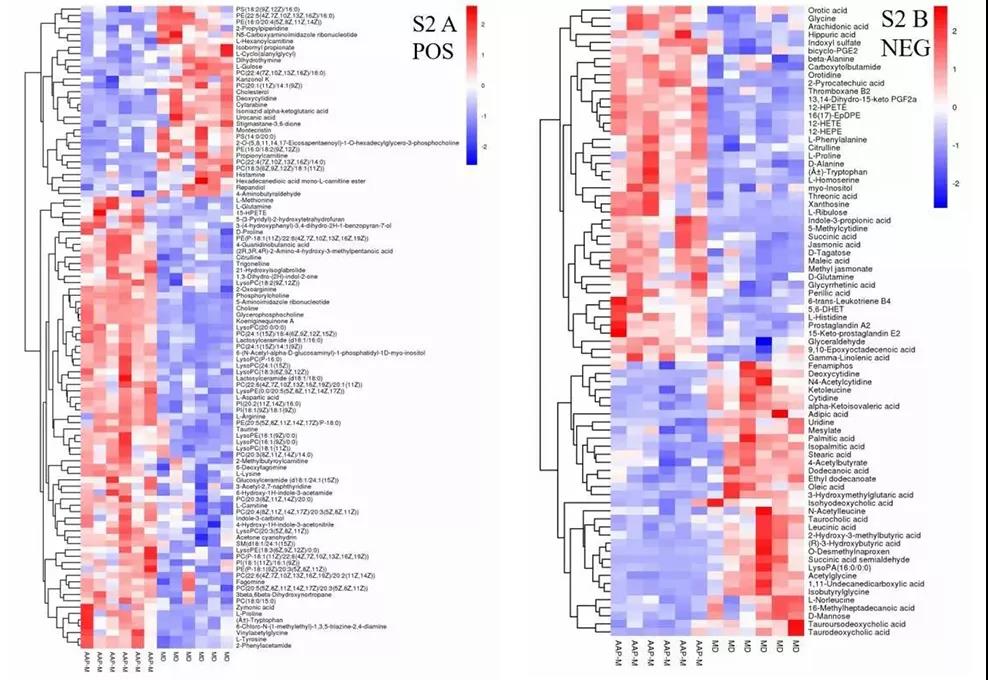
图4. UHPLC-QE HFX-MS技术检测血清中的代谢物变化
基于以上筛选的45种差异代谢物,对潜在的代谢途径进行分析。利用KEGG数据进行通路富集分析,绘制代谢通路的气泡图(图5),以探索AAP缓解T2DM最相关的通路及可能的机制。AAP-M处理可调控5个潜在代谢途径:精氨酸和脯氨酸代谢、氨基酰- trna生物合成(氨基酸代谢)、不饱和脂肪酸生物合成(脂质代谢)、甘油磷脂代谢和初级胆红酸(BA)合成。图5显示了这些途径之间的关系以及在AAPs影响下相关代谢物的变化。综上所示,AAP-M组与MD组相比具有独特的代谢途径。
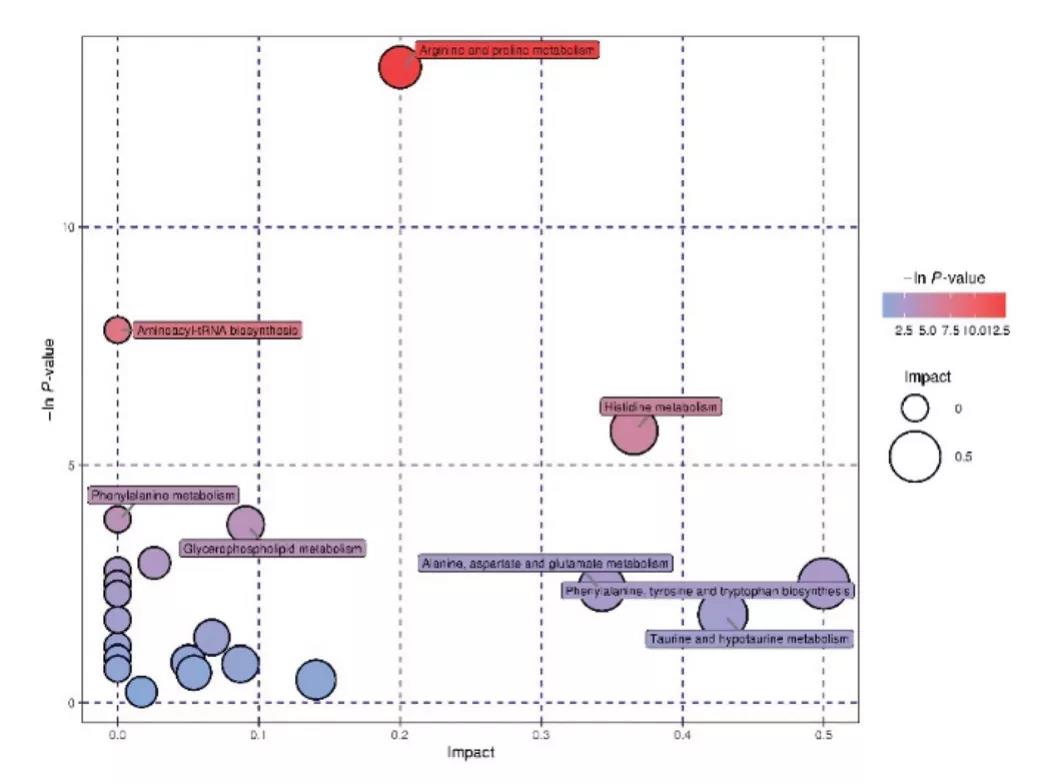
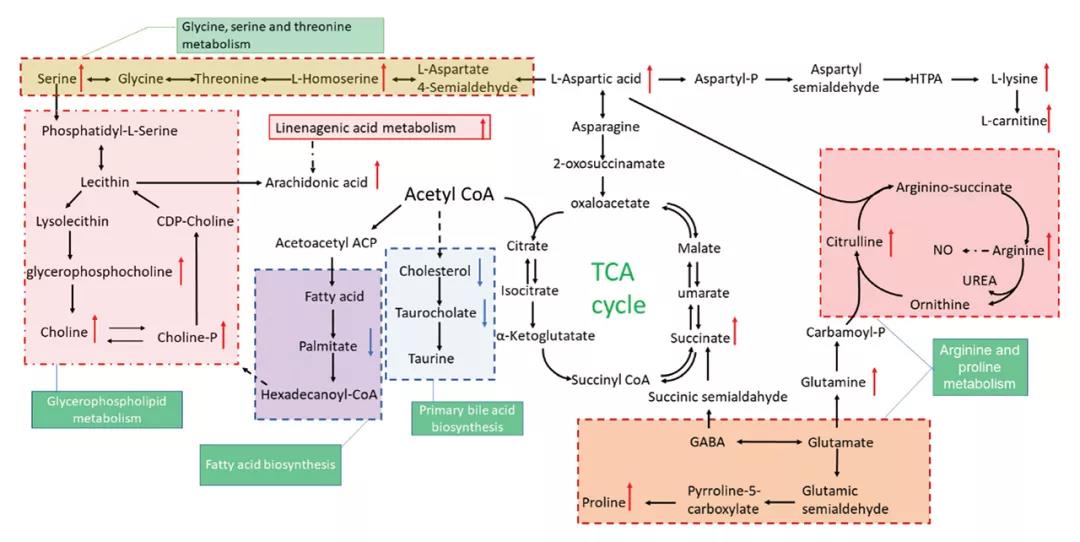
图5. 代谢通路的气泡图及相关途径代谢物变化
研究结论
文献原文下载链接:
https://pan.baidu.com/s/1HyC4ajE2ej-gRzt7wNfUdQ
提取码:h2im
