α-突触核蛋白与帕金森氏症的病因与疾病发展有着密切的联系。帕金森氏症 (PD) 是一种神经衰退疾病,该疾病患者的大脑中可见α-突触核蛋白聚集形成路易体。α-突触核蛋白是由SNCA基因表达的一种分子量为 14-kDa 的蛋白。目前已知的α-突触核蛋白的自然状态可有很多种:可能是没有折叠的单体1、折叠的四聚体、或者是处于和其他寡聚体动态共存的形式2。在帕金森疾病中,这些分子量小的α-突触核蛋白会聚集形成原纤维、纤维以及路易体,从而导致神经元的病变和死亡。也有其他研究表明寡聚体和原纤维具有神经毒性3-6而路易小体可能有神经保护功能7。
|
|
|
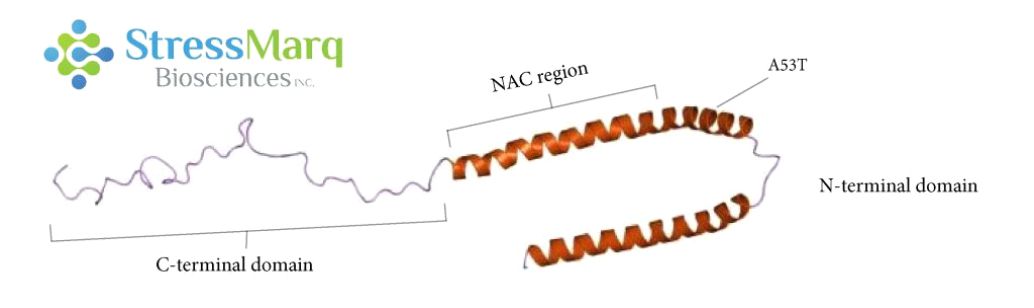
α-突触核蛋白由三个主要区域:羧基末端区域、NAC区域、以及氨基末端区域。A53T 突变位于氨基末端区域。 |
A53T是错义点突变, 也就是导致了氨基酸的改变:第53个氨基酸由丙氨酸突变为苏氨酸。该突变是由于SNCA基因 209位置的鸟嘌呤变成了腺嘌呤 (G209A)8。A53T 突变与一种常染色体显性遗传的早发型 PD 相关,这种 PD 最先发现于意大利和希腊裔家族8,也见于一个韩国裔家族9。 A53T 变异导致该疾病的发病年龄比较早8。虽然大部分的 PD 病例是散发型的,并非遗传病,而且也不涉及 A53T 突变, 但是研究 A53T 突变可以帮助科研学者们更好的了解α-突触核蛋白的聚集和发展机制,从而研发出更好的疾病模型和治疗方案。
|
|
|
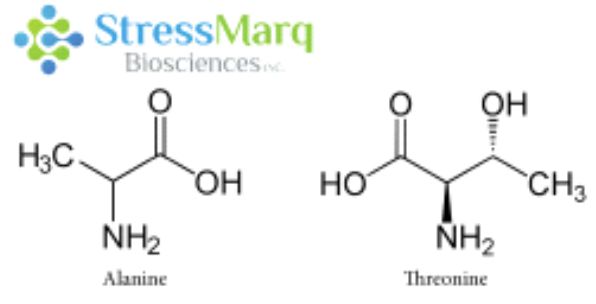
丙氨酸和苏氨酸有相似的结构,但是α-突触核蛋白中的丙氨酸替换成苏氨酸对α突触核蛋白的纤维原聚集有很大的作用。 |
A53T 变异只涉及到单一氨基酸改变,而且丙氨酸和苏氨酸结构上非常相近,那么为什么A53T突变型有这么强的聚集效果呢?这是因为A53T和其他致病突变都发生在α-突触核蛋白的氨基末端,理论模型显示 A53T 突变会使α-突触核蛋白的 NAC 区域和氨基或羧基区域的长程相互作用消失,导致 beta折叠的加速形成13。NMR 测量数据显示 A53T 突变可以延长并稳定在寡聚化和纤维化中起着重要作用的 beta折叠结构14。因此A53T 突变型能够更快聚集alpha突触核蛋白,有更明显的致病效果。下面的硫黄素T检测曲线可以明显看出A53T突变型的聚集效果明显强于非突变型α-突触核蛋白。
|
|
硫黄素T是一种荧光染料,可以绑定富含beta折叠的结构,例如α-Syn聚合体。绑定之后,硫黄素T光谱会发生红移,荧光强度会增强。A53Tα-Syn蛋白单体(SPR-325)的硫黄素T发射光曲线显示了有限的荧光强度增强(相关于α-Syn蛋白聚合体)。而10nM活性α-Syn聚合体(SPR-326)与100μm活性α-Syn单体(SPR-325)混合时荧光强度明显增强,这是由于聚合体催化了活性单体形成更多聚集体PFFs。ThioflavinTλex=450nm,λem=485 nm。 |
|
|
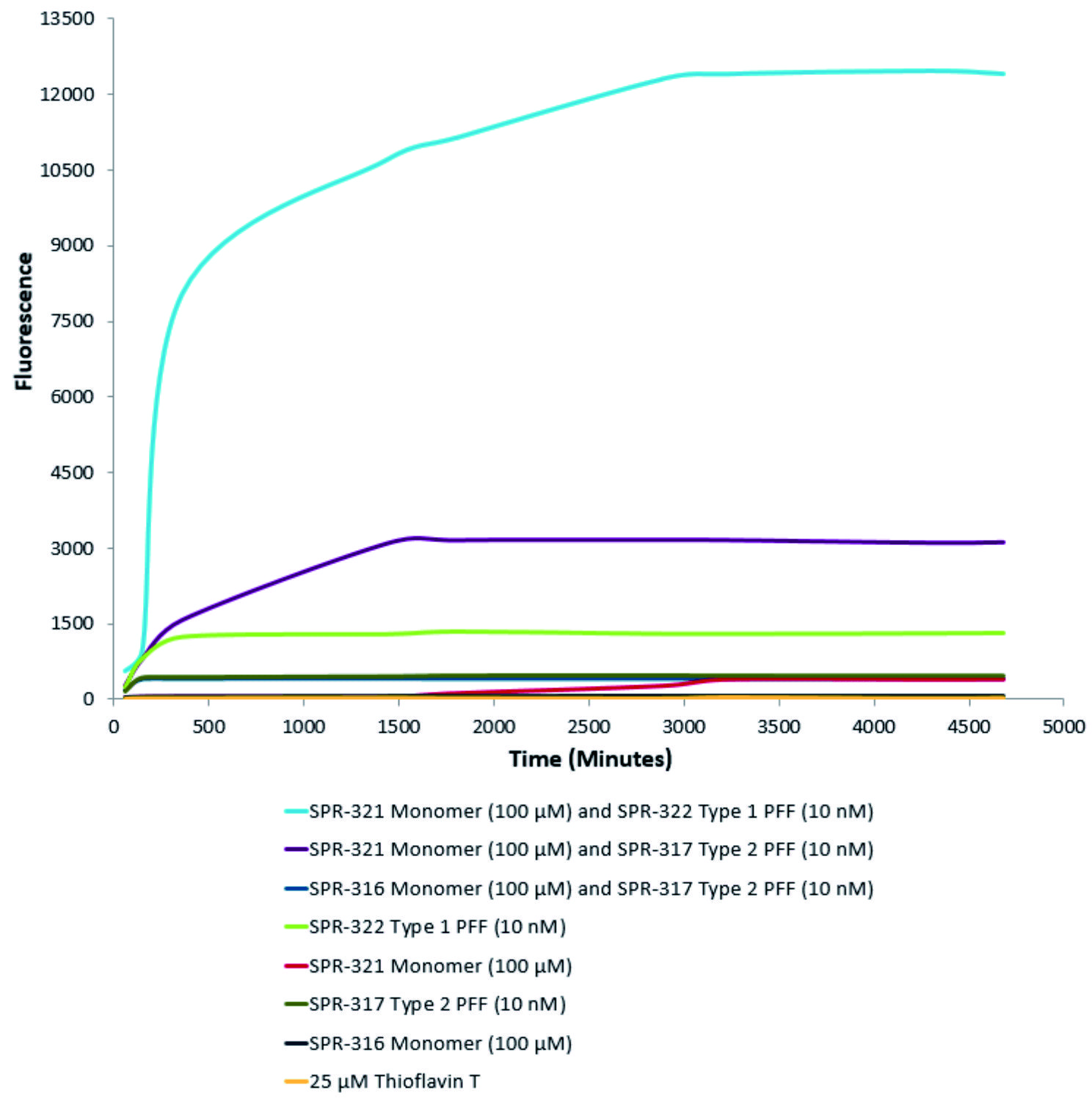
活性突触核蛋白(α-Syn)聚合体(SPR-322)催化活性单体(SPR-321)形成新的聚合体。硫黄素T是一种荧光染料,可以绑定富含beta折叠的结构,例如α-Syn聚合体.绑定之后,硫黄素T光谱会发生红移,荧光强度会增强。左侧硫黄素T发射光曲线展示了四种试验对象随时间增强的荧光强度(相关于α-Syn 蛋白聚合体),其中10nM活性α-Syn聚合体(SPR-322)与100μm活性α-Syn单体(SPR-321)混合物荧光增强最明显,另外几组对比分别是活性α-Syn聚合物(SPR-322)、活性α-Syn单体(SPR-321)以及ThioflavinTλex=450nm,λem=485 nm。 |
A35T突变型alpha突触核蛋白新品上市半价促销,活动时间2019年3月1日至4月30日,折扣码 A35T50。
|
SPR-325B |
100 µg |
|
|
SPR-325C |
2 x 100 µg |
|
|
SPR-325E |
5 x 100 µg |