
肺癌是我国恶性肿瘤发病率及死亡率排名首位的癌种,同时发生恶性浆膜腔积液 (MSE)的晚期肺癌患者的预后明显更差。预测局部晚期或转移性肺癌患者的肿瘤类器官是精准医学中预测临床对治疗反应的一种潜在方法。然而,由于难以生成纯肿瘤类器官,其在肺癌中的临床应用鲜有报道。
2023年1月,广东省人民医院杨衿记教授团队在Cell Reports Medicine(IF 16.988)期刊上发表了题为“Using patient-derived organoids to predict locally advanced or metastatic lung cancer tumor response: A real-world study”的文章。该研究首次大规模收集晚期肺癌患者的浆膜腔积液(MSE)或肿瘤组织成功培养了162例类器官模型,并基于类器官的药物敏感性测试(LCO-DST)结果预测了LCOs临床疗效的准确性,且发现了LCOs具有预测联合治疗方案的巨大潜力。此外通过4D-Labelfree蛋白组学方式揭示了双靶向治疗明显触发细胞死亡的分子机制。中科新生命为该研究提供了4D-Labelfree蛋白质组学技术服务。

研究材料
肺癌类器官(LCOs)
技术路线
步骤1:患者源性肺癌类器官的建立及其病理、基因组分析;
步骤2:LCOs可预测患者对靶向治疗和化疗的临床反应;
步骤3:来自多个样本的LCOs显示LCO药物反应的稳定性和异质性;
步骤4:LCO药物筛选预测双靶向治疗的临床反应;
步骤5:LCOs的蛋白质组学研究揭示双靶向治疗的分子机制。
研究结果
1. 患者源性肺癌类器官的建立及其病理、基因组分析
在本研究中,作者共收集了107名晚期癌症患者的214例样本用于生成类器官,成功建立了162例LCOs(肺癌类器官)(图1A)。其中132例LCOs来源于肺癌患者的恶性浆膜腔积液(MSE)样本,建模成功率高达81.5%。
作者首先通过HE染色和IHC免疫组化方法将LCOs与原始组织进行形态和病理的比较分析,结果发现类器官样本与同源的临床样本一致率为77.6%,表明LCOs保留了原始肿瘤组织或MSE的组织病理学特征并可反映其个体特征(图1左)。
随后作者对LCOs与临床样本的基因组的一致性进行验证(以MSE衍生的LCOs和MSE基因组作为参照)(图1右),结果发现类器官样本所有体细胞突变的敏感性达到70.1%,特异性为97.7%。表明MSE和LCOs样本之间的基因组谱具有可接受的一致性。
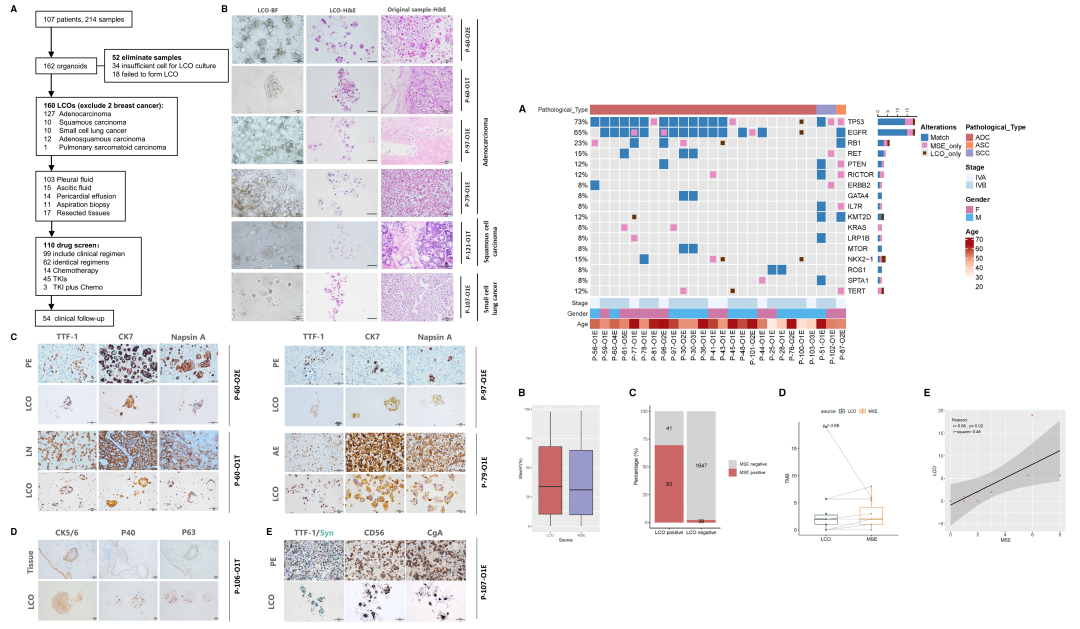
图1 肺癌类器官样本与同源临床样本的病理学(左)分析和基因组分析(右)
2. LCOs可预测患者对靶向治疗和化疗的临床反应
作者随后开展了基于类器官模型的靶向治疗和化疗的敏感性试验来预测临床肿瘤疗效。作者将来自36例临床方案与LCO-DST(类器官的药物敏感性测试)结果相同的患者的54例LCOs分为四组:奥希替尼、化疗、双靶向治疗和其他靶向治疗组。类器官药敏结果和临床疗效的一致性分别为 86.7%, 83.3%, 100%, 和70.6%,总体的准确率为83.3%(45/54)。通过LCO-DST的结果与其对临床治疗的指导结果进行比较分析,证实使用LCO-DST可以准确预测大多数患者的临床反应、对靶向治疗药物的耐药性以及对化疗的反应(图2)。
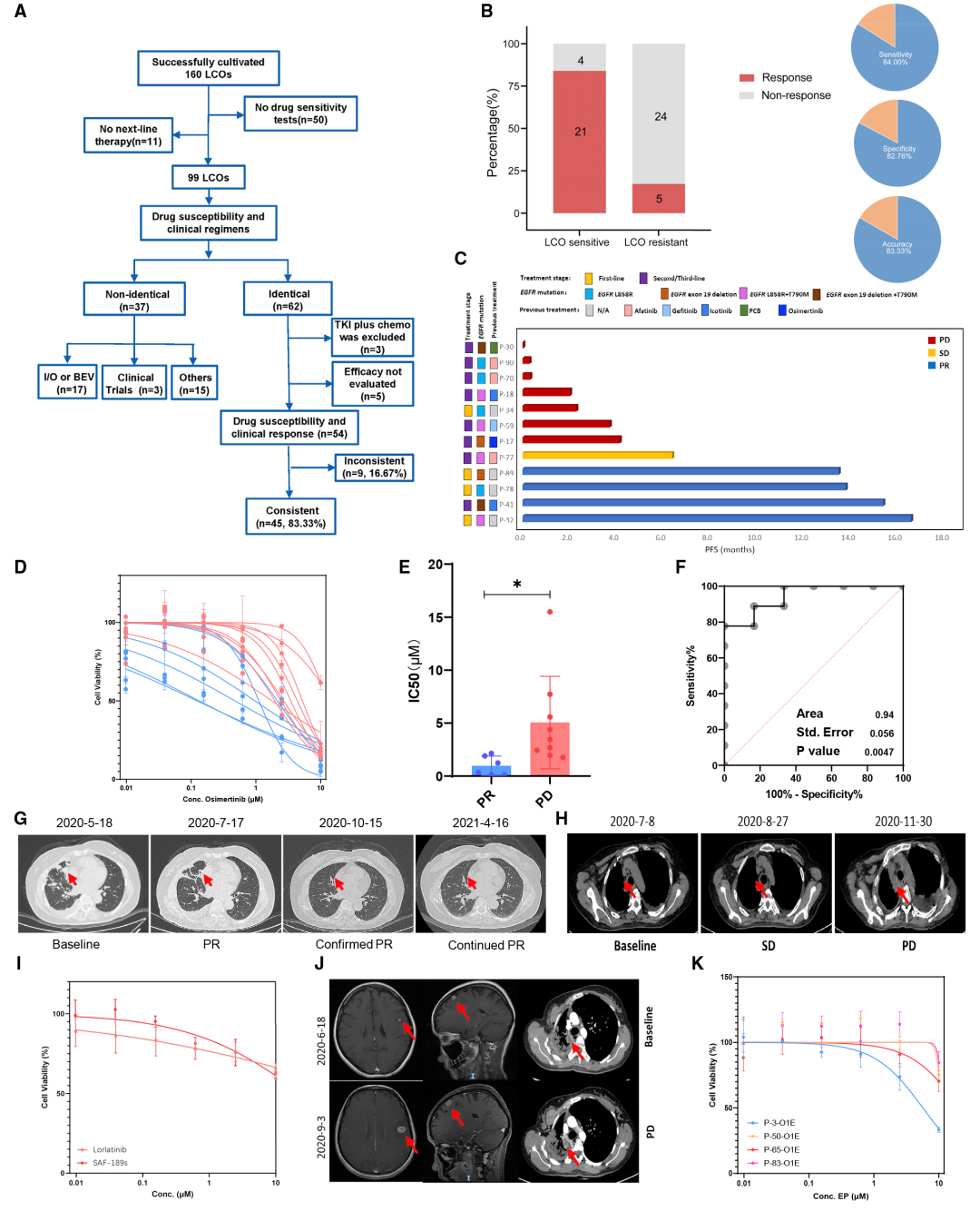
图2 LCOs预测对靶向治疗和化疗的个性化反应
3. 来自多个样本的LCOs显示LCO药物反应的稳定性和异质性
除了模型的成功率和纯度,使用肿瘤类器官进行药物筛选的另一个挑战是实验稳定性。此外,肿瘤间和肿瘤内的一致性对于临床治疗也是一项巨大的挑战。为此作者收集了同一患者的不同样本(在不同时间提取MSE样本)、不同患者的不同部位进行类器官培养,并进行体外LCO药物反应,实验表明在这两种不同类型的样本中,LCO-DST均保持了结果的稳定性(图3)。
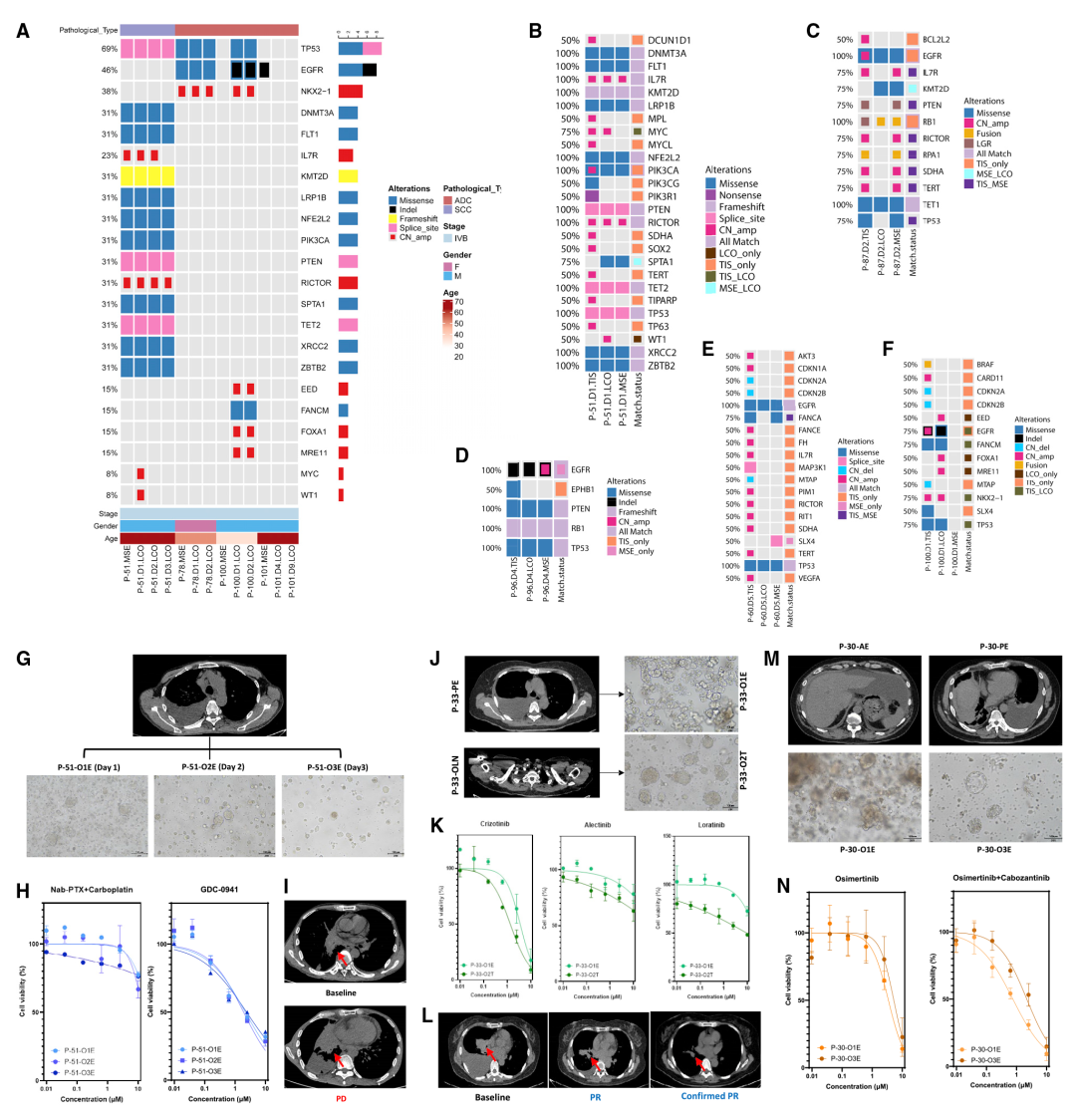
图3 来自多个样本的LCOs显示了LCO药物反应的稳定性和异质性
4. LCO药物筛选预测双靶向治疗的临床反应
晚期肺癌患者对单一抗癌药物的耐药性是很常见的,因为先采用LCO-DST进行联合靶向治疗效果的体外评价,对于肿瘤患者的临床治疗是非常有帮助的。作者选择两例晚期肺腺癌的典型案例:一例EGFR基因突变合并原发MET基因扩增,另外一例EGFR基因突变合并获得性RET基因融合。结果表明相比于单一靶向药物,联合靶向治疗(奥希替尼+赛沃替尼/卡博替尼)对肿瘤的控制率更高,并且在临床治疗中得到证实,双靶联合治疗均达到了部分缓解(PR)的疗效。此外,结果也证明了LCO-DST作为预测联合治疗方案的巨大潜力(图4)。
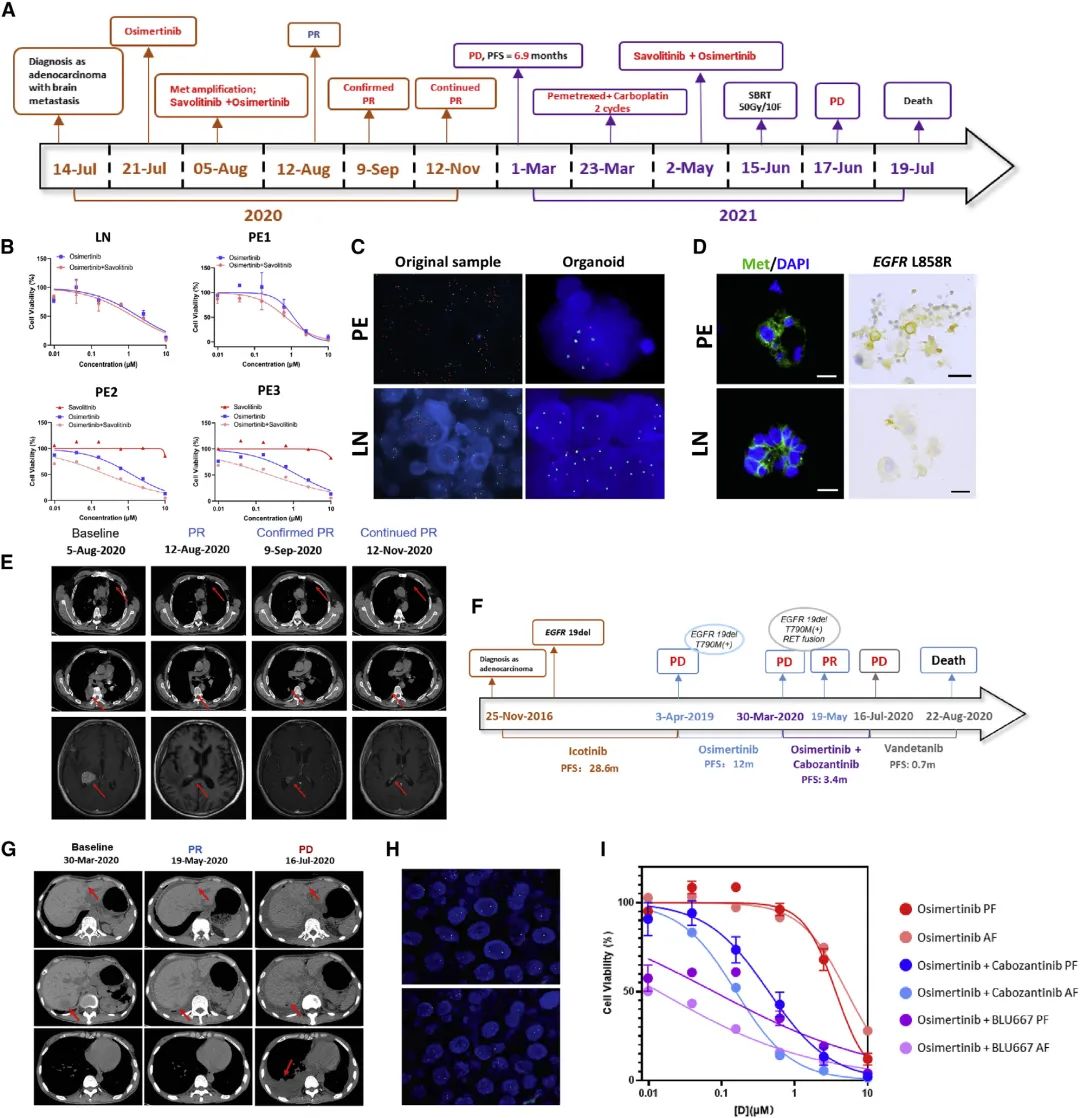
图4 LCO药物筛选预测双靶向治疗的临床反应
5. LCOs的蛋白质组学研究揭示双靶向治疗的分子机制
为进一步探索双靶向治疗的分子机制,作者进行了4D-Labelfree蛋白组学分析(组别设置:对照组(EGFR突变合并RET融合)、单靶向治疗组(osimertinib/BLU-667治疗)和双靶向治疗组)。共鉴定到4865个蛋白质。显著性差异蛋白分析发现与肿瘤细胞的存活密切相关的多个蛋白家族发生改变:引发细胞凋亡的关键因子caspase 3的表达显著升高, EGFR和RET的下游蛋白如RAC、PI3K、MEK的表达下调,MOB1和MST1/2水平显著降低,生存相关基因的关键转录因子YAP表达水平下降。这些结果均表明,与单一药物处理相比,双靶向处理显著触发了细胞死亡(图5)。
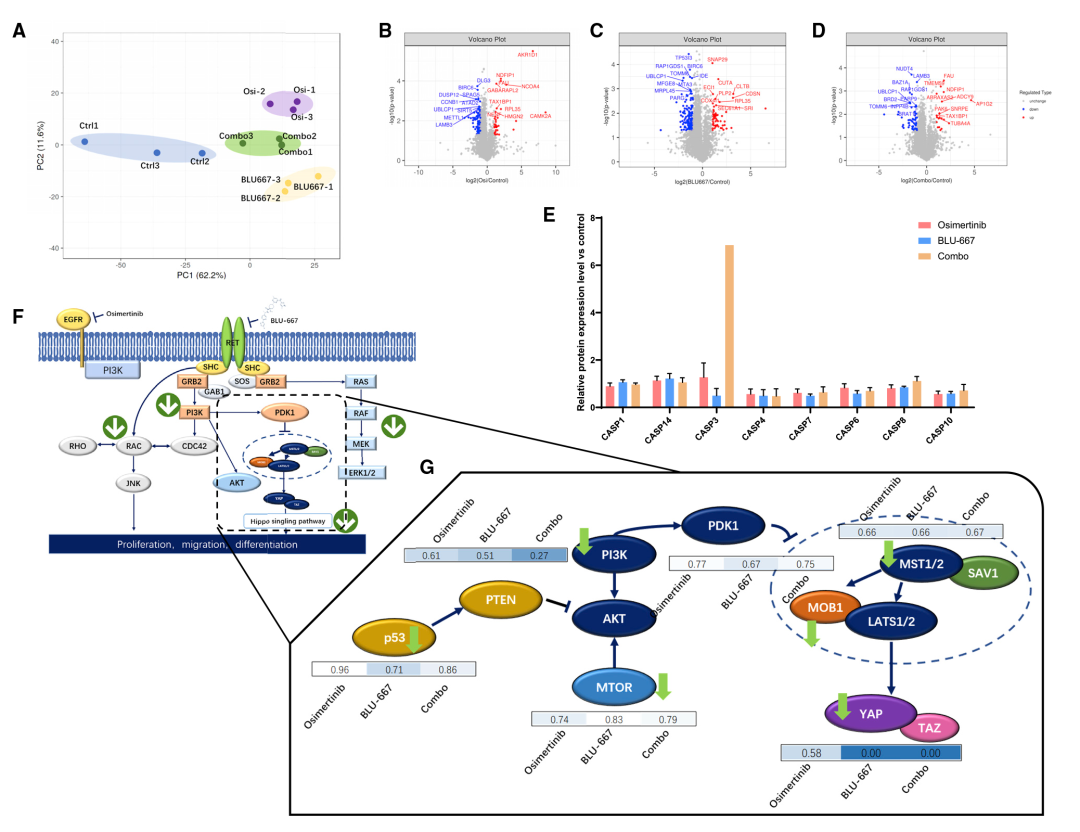
图5 LCOs的蛋白质组学研究揭示双靶向治疗的分子机制
小结
本研究中,成功建立了肺癌类器官模型,并基于肺癌类器官的药敏试验准确地预测了晚期肺癌患者抗肿瘤治疗的临床疗效,提示肿瘤类器官可作为肺癌的体外模型,其药敏试验可作为晚期肺癌的精准医学或个体化医疗的有效预测工具。此外,双靶向治疗机制的研究对于诠释双靶向治疗的疗效提供了有力的依据。
