
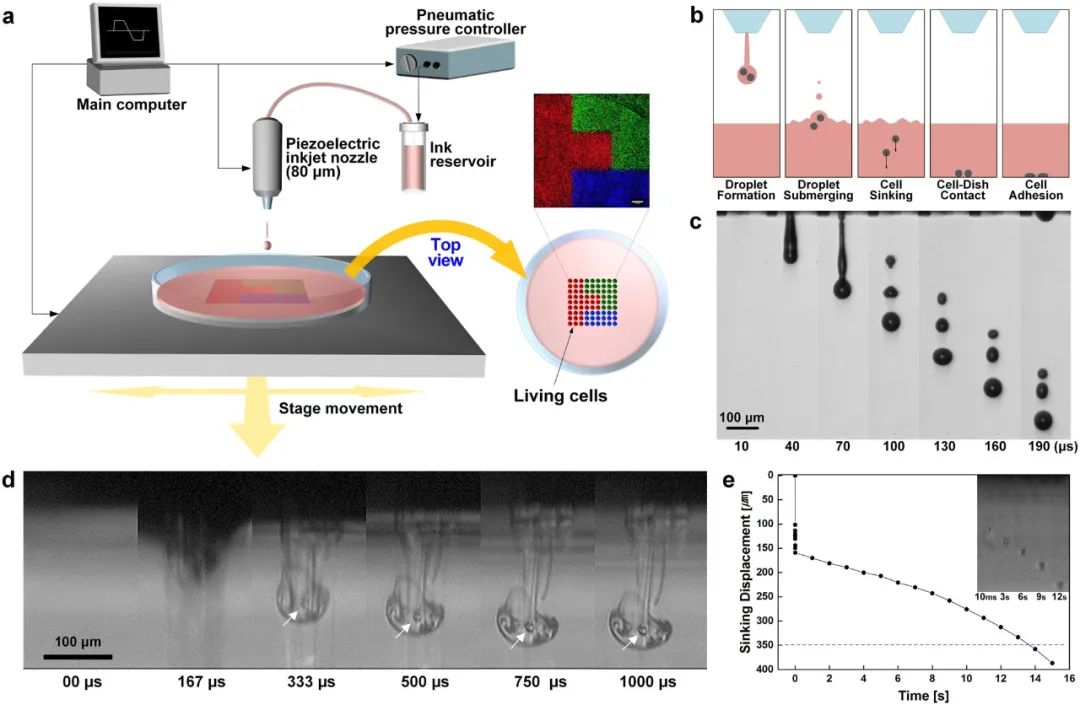
微制造方法已广泛用于控制微米级的局部细胞环境。然而,准确地模拟体内的复杂性在同一基质上共培养多种类型的细胞时,在保持形式和设计自由的同时保持组织结构仍然是一个挑战。喷墨打印是解决这个问题的最佳办法之一,可以通过直接将活体细胞图案化打印到细胞友好的液体环境中,是基础生物学和应用生物技术的强大而通用的工具。
基于直接喷墨的细胞打印系统和工艺
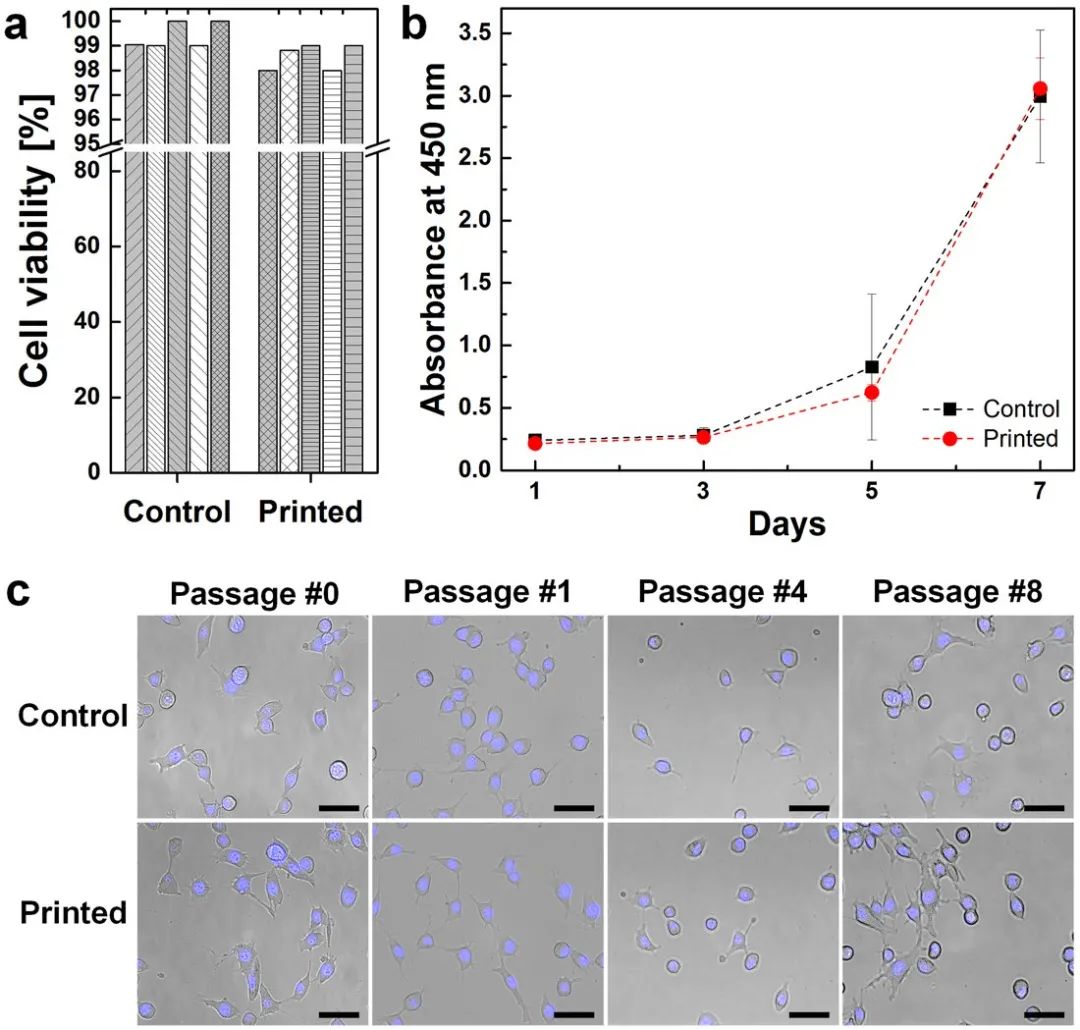
▲ 图2 印后细胞活力测试。( a ) LIVE/DEAD测定用于测量打印后立即的细胞存活率。( b ) 每隔一天测量增殖率,持续7天。(c)监测长期细胞形态直至第8代。比例尺:50μm。


参考文献:
[1] Park J A , Yoon S , Kwon J , et al. Freeform micropatterning of living cells into cell culture medium using direct inkjet printing[J]. Scientific Reports, 2017, 7(1):1669.
