结直肠癌(CRC)是全球最常见的恶性肿瘤之一,也是导致癌症相关死亡的主要原因之一。CRC的发生和发展是一个多步骤过程,受到包括遗传因素和环境因素在内的多种因素的复杂影响。近年来,肠道菌群失调,特别是某些特定细菌,如具核梭杆菌(Fusobacterium nucleatum)、肠毒性脆弱拟杆菌(ETBF)和某些类型的大肠杆菌(E.coli)等,在CRC发生中的作用越来越受到关注。
2024年8月5日,上海仁济医院房静远教授团队在著名学术期刊Cell Host & Microbe(IF 20.6)在线发表了题为“BCAA-producing Clostridium symbiosum Promotes Colorectal Tumorigenesis Through the Modulation of Host Cholesterol Metabolism”的研究论文。通过队列研究、多组学技术、动物模型、功能验证等多种研究方法,揭示了共生梭菌C.symbiosum及其代谢产物与CRC患者临床特征的关联及其致癌机制。(麦特绘谱提供Q300全定量检测服务)
此前,房静远教授团队多次与麦特绘谱合作在肠菌研究方向发表了多篇研究文章,成果展示如下:
●Disruption of CerS6-mediated sphingolipid metabolism by FTO deficiency aggravates ulcerative colitis(Gut,2023IF=24.5,麦特绘谱提供神经酰胺定量检测服务)
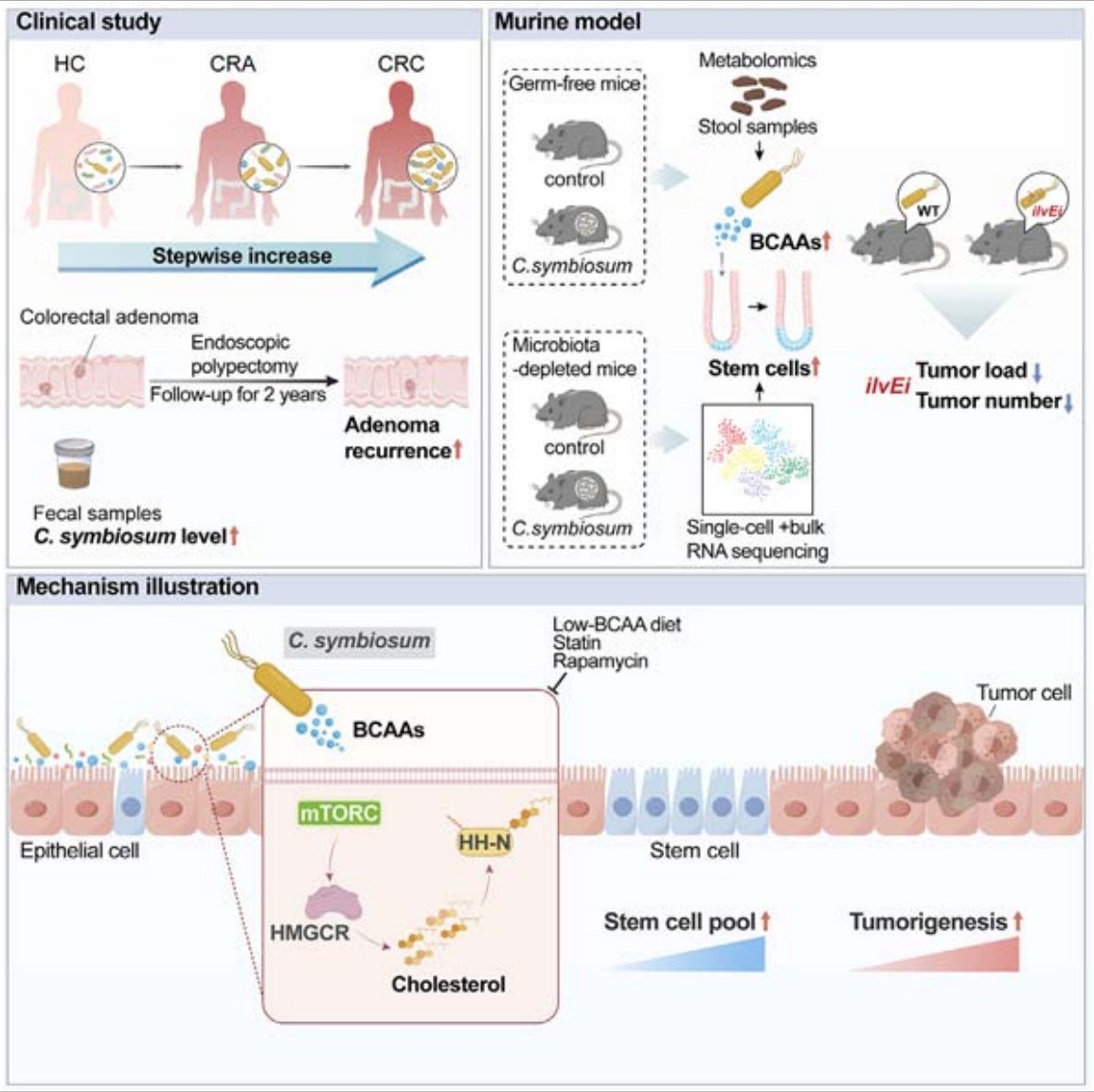
研究思路
图1. 技术路线
研究结果
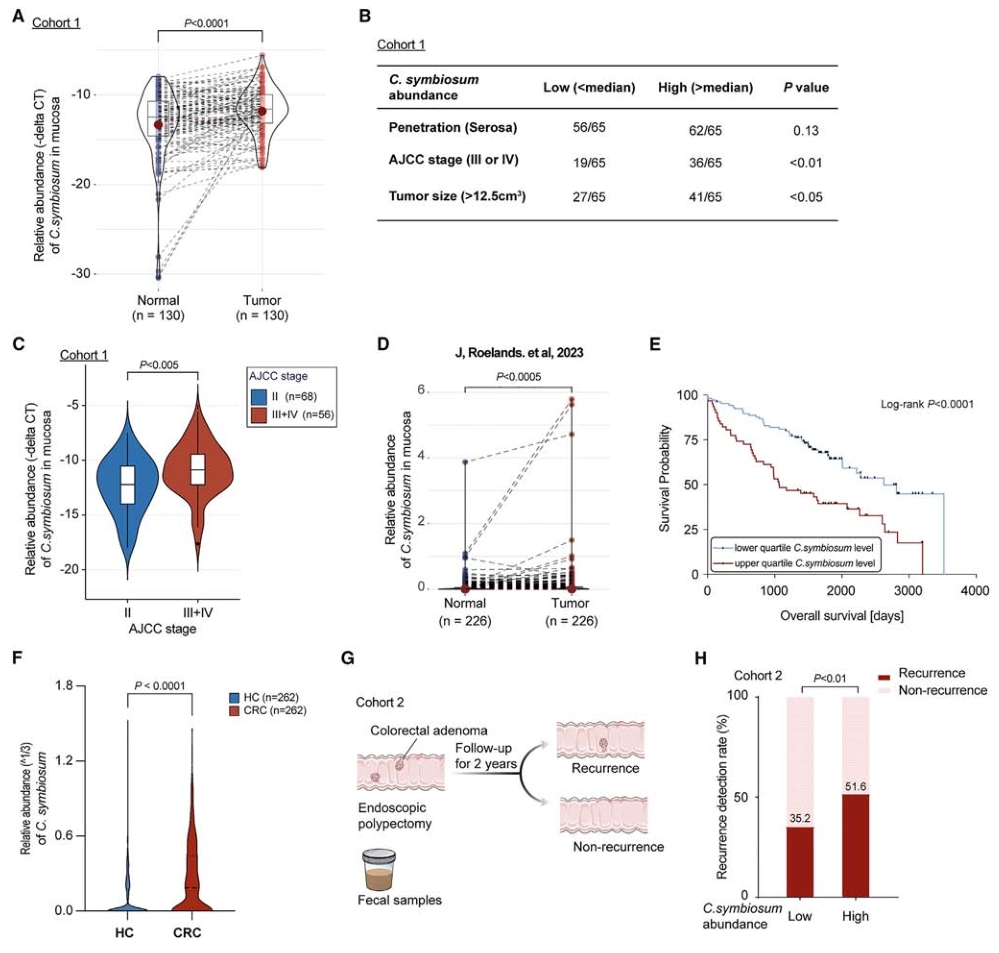
1. C.symbiosum在CRC患者中的临床特征
建立临床队列,在队列1中纳入130名CRC患者,发现肿瘤组织中的C. symbiosum丰度显著高于正常组织且C. symbiosum在肿瘤组织中的水平与肿瘤大小呈正相关。根据从公共数据集检索的宏基因组数据,在几个西方队列中进一步验证了CRC患者粪便中C. symbiosum显著富集。在队列2中,对290名结直肠腺瘤(CRA)患者进行有效监测,结果显示,高C. symbiosum丰度的患者,CRA复发的病例更多。综合队列1和队列2的结果表明C. symbiosum水平不仅在CRC患者的粪便中升高,而且在肿瘤组织中也升高。
图2. C. symbiosum在腺瘤复发患者中富集,与结直肠癌患者的临床特征相关
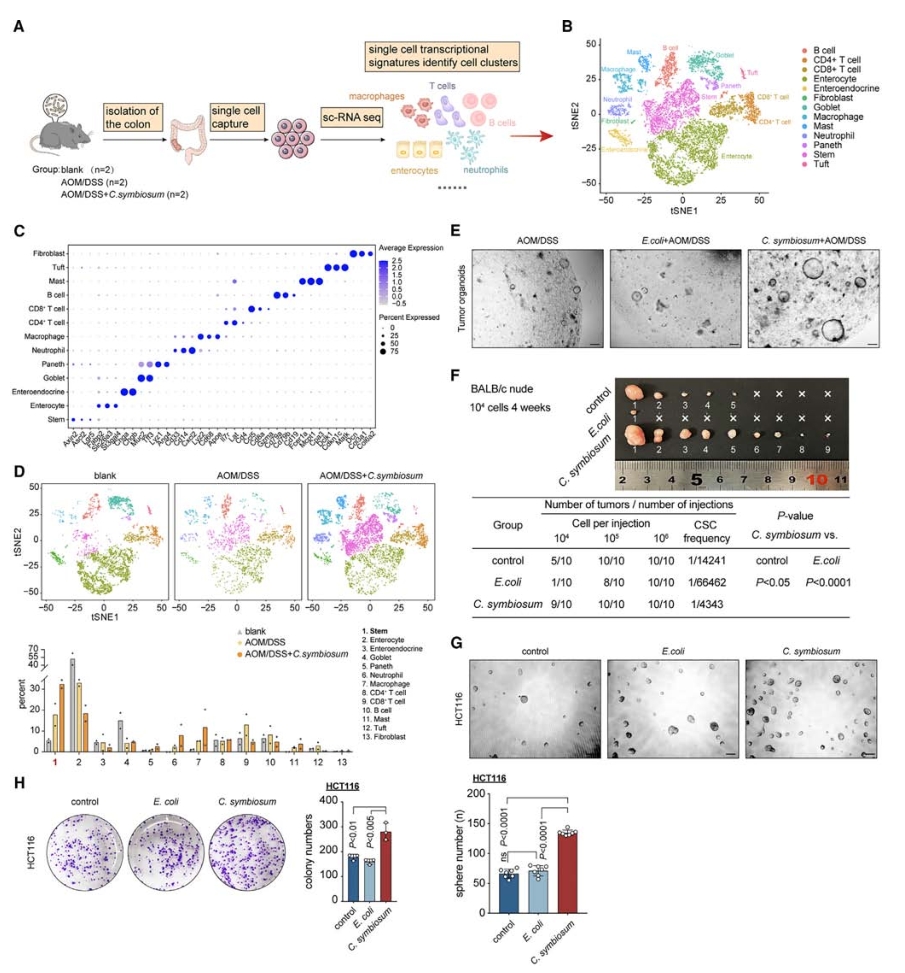
2.C. symbiosum促进结直肠癌的发生和生长
根据前文提到的临床表征,建立了3种细菌缺失小鼠模型,即结肠炎相关癌(CAC)模型、偶氮甲烷(AOM)为基础的散发性肿瘤模型和ApcMin/+小鼠模型,进一步探索C. symbiosum对结直肠肿瘤发生的影响。在CAC模型中,C. symbiosum灌胃组小鼠的结肠肿瘤数量和肿瘤负荷显著增加,组织学和免疫组化检查显示,C. symbiosum小鼠出现了高级别异型增生,且肿瘤区域和正常上皮中的Ki67阳性细胞(高Ki67表达通常与肿瘤细胞的高度增殖活性和更差的预后相关)比例较高,表明C. symbiosum促进了上皮细胞的增殖。在ApcMin/+小鼠模型和AOM诱导的散发性肿瘤模型中,也得到了类似的结果,证实了C. symbiosum增加了结肠肿瘤数量和肿瘤负荷。
此外,为了排除SPF小鼠受到的常规微生物环境和结肠免疫微环境的影响,采用无菌小鼠模型进行了验证,结果也证实了C. symbiosum促进结肠肿瘤的发生和生长及Ki67细胞的增殖。
结合体外细胞功能实验,发现C. symbiosum显著促进了正常上皮细胞系NCM460和结肠癌细胞系HT29、HCT116的增殖。
图3. C. symbiosum在体内和体外促进结直肠肿瘤发生和肿瘤生长
3.C. symbiosum增强小鼠结肠干细胞特性
进一步剖析C. symbiosum对小鼠结肠组成和功能的影响,对无菌小鼠的结肠组织进行单细胞转录组学测序分析,捕获到14067个细胞,包括多种上皮细胞、免疫细胞和间质细胞。通过研究干细胞标记基因表达情况,发现空白组、AOM/DSS处理组和C. symbiosum定殖AOM/DSS诱导组的干细胞比例逐步增加,表明C. symbiosum可能在结肠干细胞的增殖和更新中扮演重要角色,进而促进结肠肿瘤的发生。基于此结果,从AOM/DSS诱导的小鼠模型中分离出结肠肿瘤干细胞,并进行类器官形成实验,发现C. symbiosum显著促进了肿瘤器官样体的形成和生长。极限稀释实验、肿瘤球体和菌落形成实验也表明了C. symbiosum显著促进了结肠肿瘤的生长。
图4. 在体内和体外均可提高结肠干细胞的比例,促进干细胞的形成
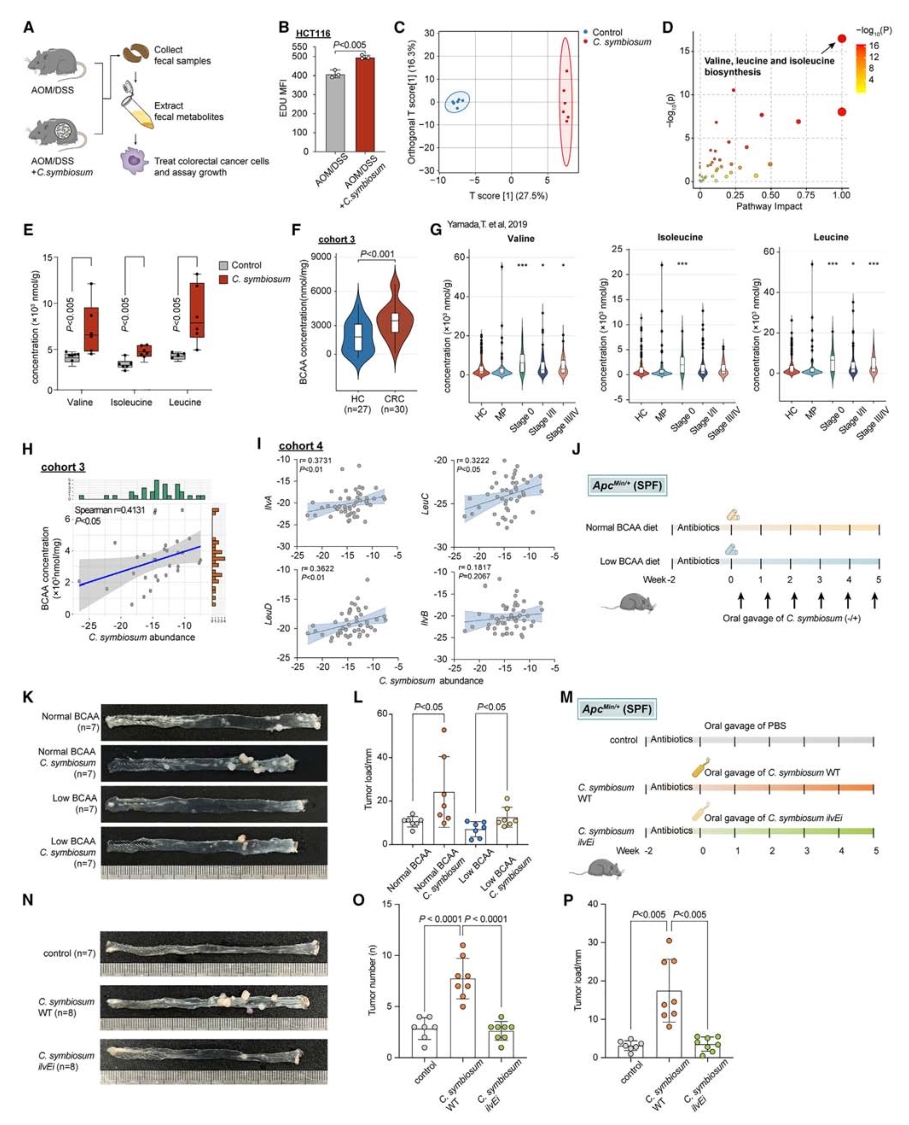
4. C.symbiosum通过产生BCAAs发挥致癌作用
使用微生物群耗竭的小鼠模型,通过口服给予磷酸盐缓冲液(PBS)、活的C. symbiosum以及热杀死的C. symbiosum,同时诱导小鼠发生CRC(使用AOM/DSS模型)。实验结果显示,活的C. symbiosum灌胃促进了肿瘤生长,而热杀死的C. symbiosum则没有这种效果,表明C. symbiosum可能通过产生生物活性因子来发挥其增殖作用。与此同时,来自C. symbiosum定殖小鼠的粪便代谢产物和CFS(C. symbiosum的无细胞上清液)均能促进CRC细胞系的增殖,进一步支持了C. symbiosum的相关代谢物是其致癌作用的基础。对C. symbiosum定殖小鼠的粪便样本进行了全定量靶向代谢组学分析(麦特绘谱提供),发现78种代谢产物显著改变,其中缬氨酸、亮氨酸和异亮氨酸途径高度富集,即支链氨基酸(BCAAs)在C. symbiosum定殖小鼠的粪便中显著升高。
使用BCAA缺乏的饮食模型结合C. symbiosum灌胃,发现低BCAA饮食在一定程度上抑制了ApcMin/+小鼠的肿瘤负荷。此外,通过CRISPR-Cas12a系统构建了ilvE基因干扰的C. symbiosum(ilvEi),该菌株BCAA分泌能力显著降低,其在微生物群耗竭的ApcMin/+小鼠模型中的致癌作用也明显受到抑制。
图5. C.symbiosum通过产生BCAAs发挥致癌作用
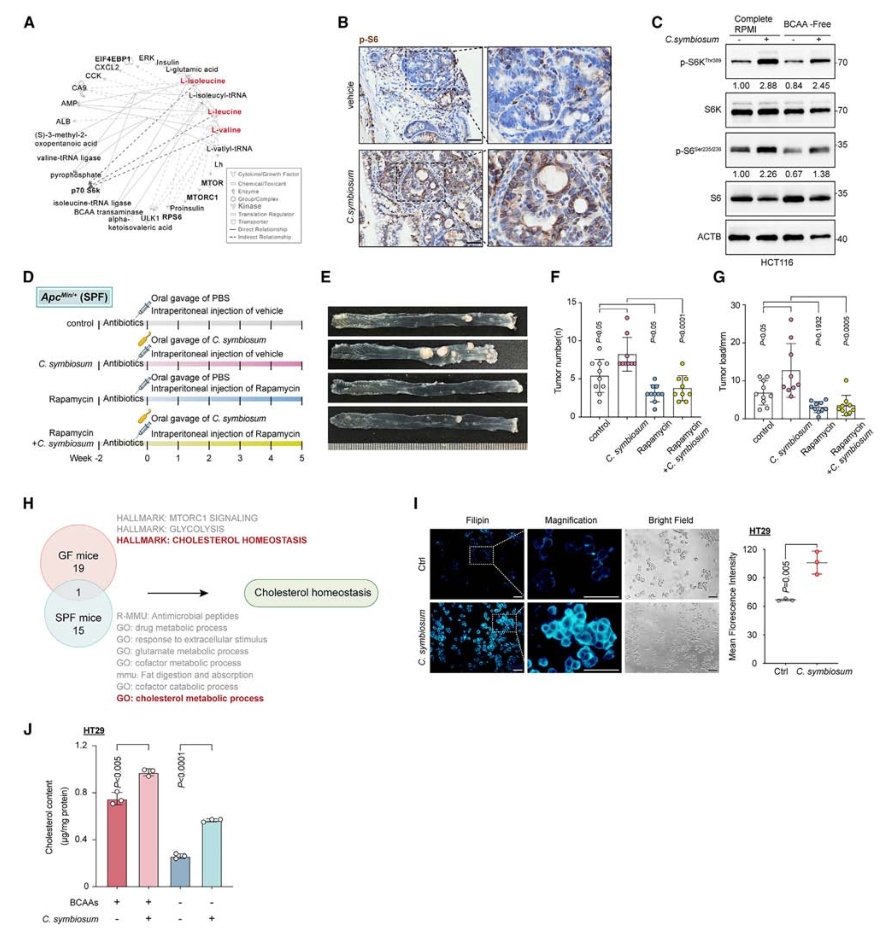
5. C. symbiosum通过mTORC1信号传导促进细胞胆固醇合成
通过IPA分析三种BCAAs和宿主中与细胞生长和增殖相关的信号节点,发现BCAAs与mTORC1(哺乳动物雷帕霉素靶蛋白复合物1,细胞生长和代谢的关键调节因子)信号通路之间存在高度连接的网络。scRNA-seq的通路富集分析显示,在C. symbiosum定植的小鼠中,mTORC1在干细胞群体中是最显著的通路。
结合体内实验、体外实验以及使用雷帕霉素抑制mTORC1进一步证实了C. symbiosum能显著刺激mTORC1信号,证明了mTORC1在C. symbiosum促瘤过程的关键作用。
此外,通过RNA-seq和scRNA-seq的通路富集分析,胆固醇稳态通路均被富集,表明C. symbiosum可能影响胆固醇代谢。在细胞实验中,与C. symbiosum共培养的NCM460、HT29和HCT116细胞的游离和总胆固醇水平显著增加,使用雷帕霉素处理显著降低HCT116细胞中的胆固醇含量,表明mTORC1信号对胆固醇合成有重要影响。
图6. C. symbiosum通过mTOR信号传导促进细胞胆固醇合成
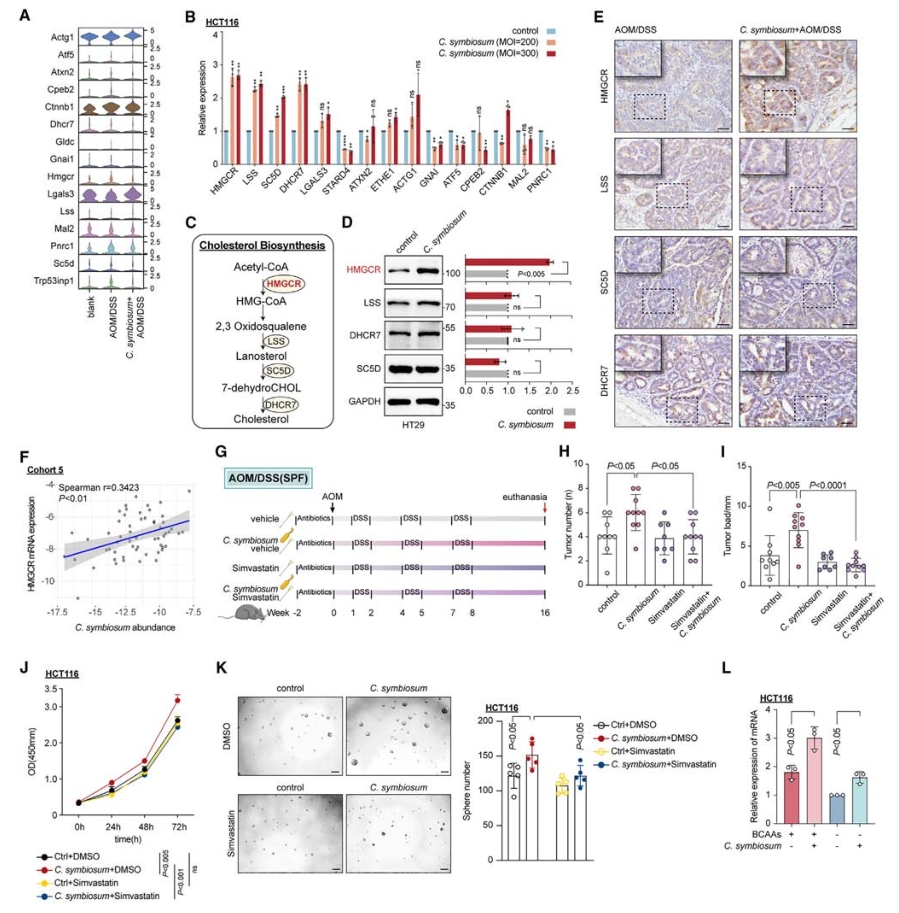
6. C. symbiosum通过调控胆固醇合成来促进细胞增殖和干细胞特性的机制
qPCR和Western Blot结果显示NCM460、HT29和HCT116细胞与C. symbiosum共培养时,参与胆固醇合成的基因(HMGCR、LSS、SC5D和DHCR7)mRNA水平在多重感染(MOI)依赖的方式下普遍上调。TCGA-COAD和GETEx数据库分析显示了HMGCR在CRC肿瘤样本中的表达显著上调,siRNA敲低实验及患者队列数据分析也论证了C. symbiosum通过调控HMGCR促进胆固醇合成。
进一步研究C. symbiosum促进细胞增殖和干细胞特性是否依赖于胆固醇合成,使用HMGCR抑制剂辛伐他汀(simvastatin)来阻断细胞内的胆固醇合成,体内和体外实验证明了C. symbiosum确实通过调控胆固醇合成来促进细胞增殖。
图7. 抑制胆固醇合成一定程度消除了C. symbiosum促进的细胞增殖
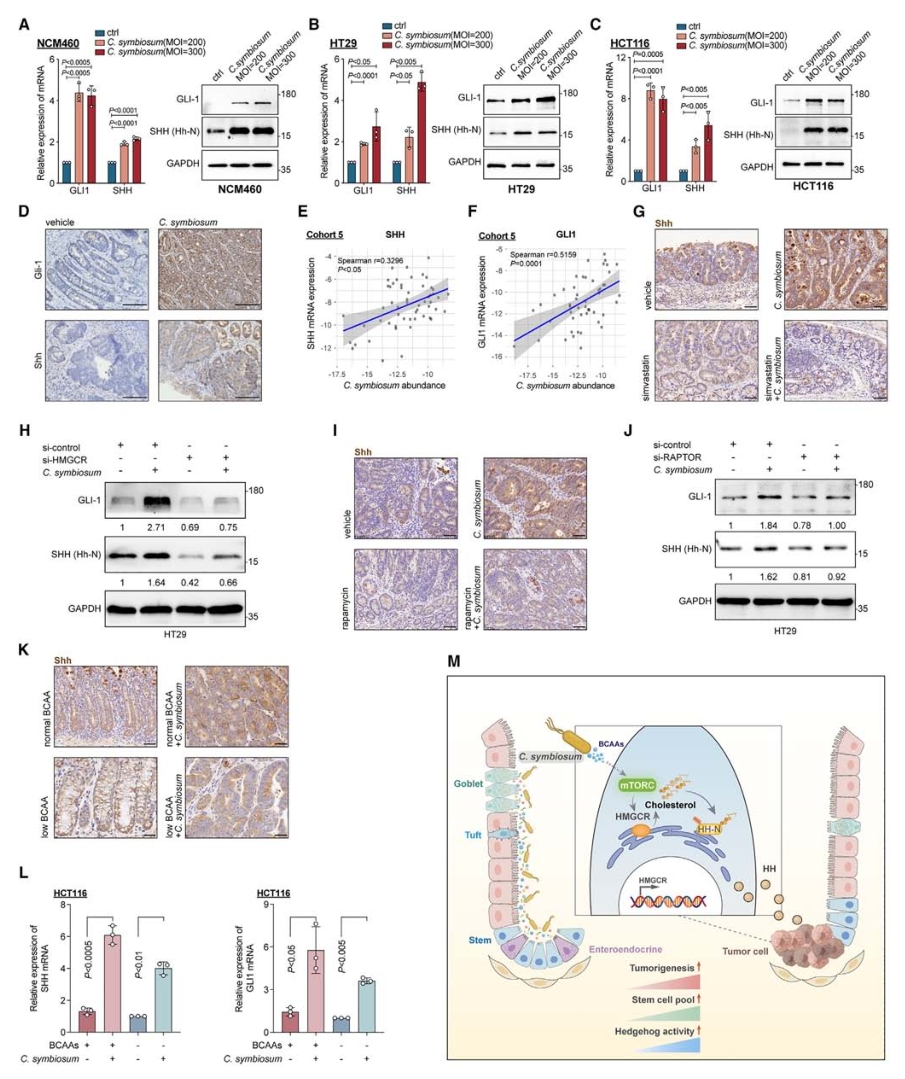
7. C. symbiosum通过诱导胆固醇合成激活Hedgehog信号通路
大量研究表明胆固醇主要是通过触发Sonic Hedgehog(SHH)信号通路的激活来维持癌细胞干细胞特性,基于此观点,使用qPCR和免疫印迹技术检测了SHH信号通路的关键节点基因GLI1和SHH的表达,结果显示C. symbiosum处理以MOI依赖的方式诱导了SHH信号通路的激活,体内实验和患者的肿瘤活检样本中也发现了SHH信号通路的激活。此外,特异性验证也表明了C. symbiosum对SHH信号通路的特异性影响,WNT和NOTCH信号通路的相关基因mRNA水平并未发生变化。在HT29和HCT116细胞中敲低HMGCR后,C. symbiosum诱导的GLI1和SHH上调被显著废除,进一步证明了胆固醇合成在SHH信号通路激活中的关键作用。
图8. C. symbiosum上调细胞胆固醇合成激活hedgehog信号传导
总结
共生梭菌在结直肠癌患者的肿瘤组织中选择性富集,并与结直肠腺瘤复发率相关,在多种小鼠模型中印证了共生菌的致瘤作用。单细胞转录组分析和功能分析表明,C. symbiosum促进结肠癌干细胞的增殖并增强癌症的干性。通过靶向代谢组学分析,C. symbiosum通过产生支链氨基酸来增强细胞胆固醇合成,激活Sonic hedgehog信号传导。低BCAA摄入或他汀类药物阻断胆固醇合成可在体内和体外部分阻断共生菌诱导的细胞增殖。
参考文献
BCAA-producing Clostridium symbiosum Promotes Colorectal Tumorigenesis Through the Modulation of Host Cholesterol Metabolism. Cell Host & Microbe. 2024
请扫描二维码阅读原文
绘谱帮你测
本研究中使用Q300全定量靶向代谢组学技术对C. symbiosum定殖小鼠的粪便样本进行分析,发现缬氨酸、亮氨酸和异亮氨酸显著升高,成为本文科研思路的重要线索,为之后发现胆固醇调控机制奠定基础。麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱拥有Q1000,Q500、Q300、Q200和胆汁酸、短链脂肪酸、色氨酸及咧咪衍生物、多胺和TMAO类等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章400+篇,累计影响因子4000+,平均IF>10,包括Cell, Nature, Science, Cell Metabolism, Immunity, Gut, Hepatology, Microbiome等权威期刊。