尽管胆汁的书面记录可追溯到古埃及时期,但直到20世纪BAs化学结构才被解析出来。麦特绘谱创始人贾伟院士带领的研究团队是国内开展胆汁酸研究最早的团队之一,早在2008年贾伟教授团队就提出前瞻观点-菌群代谢物是多疾病干预靶点。一直以来研究团队聚焦胆汁酸国际前沿领域,已发现胆汁酸与菌群的平衡在全身各个器官的代谢和免疫稳态调控中均发挥重要作用,可作为肥胖、糖尿病、消化道肿瘤及神经退行性疾病等多种临床疾病的干预靶点。系列观点发表在Nature Reviews Drug Discovery(2008)、Science(2012)、Nature Reviews Gastroenterology & Hepatology(2018)、Protein & Cell(2020)、SCIENCE CHINA Life Sciences(2023)等国际权威学术期刊,为贾伟教授团队的胆汁酸功能应用研究成果和后续国内外诸多学者胆汁酸相关研究奠定了坚实的基础,成为胆汁酸研究领域的重要标杆。
经过多年深厚的学术研究积累。2024年10月13日,上海交通大学贾伟教授、赵爱华研究员等研究团队在iMeta在线发表了题为“Novel microbial modifications of bile acids and their functional implications”的文章。重点概述新的胆汁酸微生物修饰,强调这些胆汁酸在生物学上的作用以及它们对胆汁酸治疗领域未来候选药物的深远意义。
要点荐读
胆汁酸(BAs)在促进小肠脂肪的消化和吸收,以及通过信号通路调节脂质和糖代谢、炎性、能量代谢方面发挥着至关重要的作用。这些由胆固醇衍生的生物分子在肝脏中合成,并在肠道微生物的作用下经历四种主要的修饰:去结合、7a-脱羟基、氧化和异构化。最近的研究把胆汁酸的重新结合产物作为第五种微生物的修饰,这为这些过程及对宿主的生物学意义提供了新的思路。近年来,人们对微生物的7α-脱羟基修饰和胆汁酸差向异构体的产生及生物作用的理解也显著加深。另外,猪胆酸(HCA)和猪去氧胆酸(HDCA)在代谢性疾病中的作用已经引起了研究者的巨大兴趣。本综述旨在巩固关于新型BAs分子的最新研究成果,评估其对新的治疗干预措施进展的潜在影响,为指导未来的药物创新工作提供有价值的见解。
肠道微生物驱动的BA-24-酰胺及它们的生物作用
自从2020年Pieter C. Dorrestein研究组鉴定了被肠道微生物修饰的3个新的胆酸(CA)24位与氨基酸的结合物,到现在已发现了超过200种的氨基酸与胆汁酸的结合物。
研究显示,肠道的各种微生物,包括来自拟杆菌属、乳酸菌属、双歧杆菌属、产气肠杆菌属、瘤胃球属和梭菌属的微生物参与了催化初级和次级胆汁酸与氨基酸的结合。胆盐水解酶(BSH)被认为是催化与甘氨酸、牛磺酸结合的胆汁酸水解的酶,它在胆汁酸的重新酰化中也发挥重要的作用。另外,即使其中不含bsh基因的微生物,如Clostridium scindens ATCC 35704也可以催化氨基酸与胆汁酸的结合。
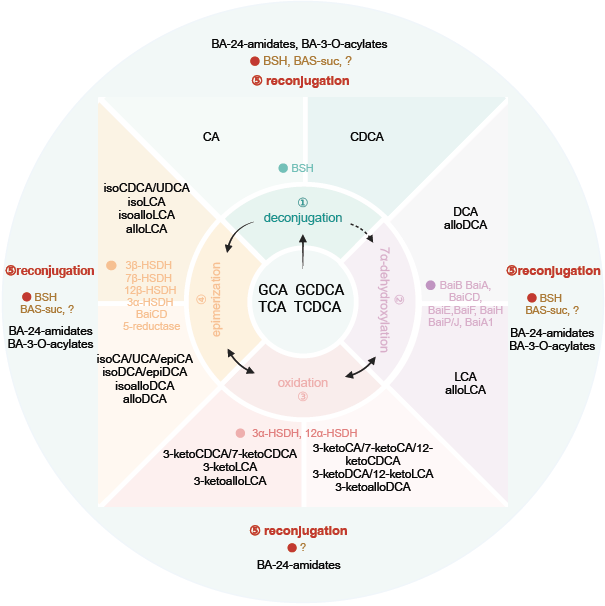
图1. 人肠道中肠道微生物驱动的胆汁酸修饰
肠道微生物通过4种主要途径转化胆汁酸:去结合(去除甘氨酸或牛璜酸)、7α-脱羟基、氧化和异构化。第五种微生物修饰—重新结合,包括在C-24位上与氨基酸或多胺形成胆汁酸-24-酰胺,在C-3位与脂肪酸或有机酸形成胆汁酸-3-O-酰基酯。黑色箭头表示胆汁酸的转化过程。特别地,结合型胆酸(CA)/鹅去氧胆酸(CDCA)经过去结合形成非结合的CA/CDCA。CA/CDCA经7α-脱羟基主要产生去氧胆酸(DCA)和石胆酸(LCA)及副产物alloDCA/alloLCA,这个过程也包含了3-酮-DCA/3-酮-LCA和isoDCA/ isoLCA的形成。DCA/LCA进一步被微生物酶催化产生3-酮-DCA/3-酮-LCA,并异构化形成isoDCA/isoLCA, epiDCA,以及alloDCA/alloLCA。异构化过程是双向的。另外,CA/DCA也可以肠道微生物氧化和异构化。绿色、紫色、粉红色和红色圆圈表示在前面所提到的迄今为止所发现的五种微生物代谢酶。BSH,胆盐水解酶;BaiB,胆汁酸辅酶A连接酶;BaiA,3α-羟固醇脱氢酶;BaiCD, 3-脱氢-Δ4-7α-氧化还原酶;BaiE, 7α-脱水酶;BaiF, 辅酶A转移酶;BaiH, 3-脱氢-Δ4-7β-氧化还原酶;BaiP/J, 5α-还原酶。
与氨基酸结合的胆汁酸在有大量微生物存在的小鼠盲肠、盲肠内容物、结肠内容物和粪便中含量丰富,但由于体外产的这类氨基酸结合胆汁酸量很低,在肝脏、小肠和血清中很少能被检出。尽管如此,与氨基酸结合的胆汁酸也可以进入肠肝循环,丙氨酸CA、精氨酸CA、谷氨酸CA、亮氨酸CA、苯丙氨酸CA、5-羟色氨酸CA、苏氨酸CA和酪氨酸CA在整个肠道以及肝脏、肾脏、血清和胆囊中均能被观察到,高含量的苯丙氨酸CA、5-羟色氨酸CA在所有组织、器官中均被发现有存在。
在克罗恩患者粪便中的丙氨酸CA、酪氨酸CA和亮/异亮氨酸CA含量增高,但在溃疡性结肠炎中并不增高,这提供了一种潜在的区分炎性肠炎类型的方法(IBD) 。并且,氨基酸结合胆汁酸可能通过调节T细胞产生IFNg以及激活孕甾烷X受体(PXR)促进肠炎。苯丙氨酸CA和酪氨酸CA可以激活人法尼醇X受体(FXR),提高在肝脏中胆汁酸合成的FXR的靶基因的表达。鹅脱氧胆酸的结合物是人FXR的主要激动剂,可以激活PXR和芳基炔受体(AHR)的转录表达。
多胺结合胆汁酸是另一类型的胆汁酸-24-酰化物。最近Pieter C. Dorrestein’s研究组发现胍丁胺、腐胺、N-乙酰精胺、尸胺、N-乙酰尸胺、N-氨基甲酰-尸胺、亚精胺、N-乙酰亚精胺、 N-乙酰精胺、N-乙酰尸胺和1,3-丙二胺均可分别与胆汁酸形成多胺胆汁酸结合物。该类胆汁酸的含量可随地中海或者典型美国饮食出现不同。
肠道微生物驱动的胆汁酸-3-O-酰基酯和它们的生物作用
最新的研究在人和鼠的粪便中鉴定出CA和CDCA,以及它们主要的次级胆汁酸脱氧胆酸(DCA)、石胆酸(LCA)、异DCA、异LCA,与从C1:0到C5:0的短链脂肪酸,主要为C16:0和C18:0的长链脂肪酸形成的胆汁酸-3-O-酰基酯。并且,胆汁酸也可以与二元酸形成酯。当CDCA和3-酮-CDCA与肠道微生物培养时,有两个缬氨酸胆汁酸的结合物被鉴定成酰基酯类,而不是酰胺类结合物。拟杆菌属菌被鉴定为在肠道细菌中胆汁酸酯化的主要细菌。体外研究显示,11种细菌具有催化短链脂肪酸与CA的结合,Christensenella 具有转化所有短链脂肪与CA的结合。姜长涛研究团队发现BAS-琥珀酸,一种在单形拟杆菌中负责琥珀酸与CA酯化的b-内酯酶。
胆汁酸-3-O-酰基酯表现出肠道特异性分布的特点,这种特异性是由于在十二指肠内容物中有一定程度的降解,从而阻止了其被吸收入血,它们生物分布的详细机制有待于进一步的研究。研究显示,3-O-酯-CAs,包括3-乙酰-、3-丙酰-、3-丁酰-、3-戊酰CA在二型糖尿病(T2D)人中被耗竭,提示它们在改善T2D中的治疗潜力。给代谢异常相关的脂肪性肝炎(MASH)小鼠3-琥珀酰CA具有促进嗜黏蛋白阿卡曼菌生长有效缓解症状的作用,提示它作为一种小分子治疗药物的潜力。BA-3-O-酰基酸酯是治疗代谢性疾病的一种很有前途的候选小分子代谢物,但还需要进一步的研究来充分了解其机制和潜在的治疗应用。
图2. 肠道微生物驱动的胆汁酸在受体中的调节作用
3-O-acyl-CAs, 3-acetylCA (acCA), 3-propionylCA (proCA), 3-butyrylcholic acid (butyCA), 和3-valerylCA (valCA)是法尼醇X受体(FXR)的拮抗剂。Phenylalano-CA (pheCA) and tyrosoCA (tyrCA)激活FXR调节胆汁酸(BA)的生物合成基因。GlutamatoCA (GluCA) 和glutamatoCDCA (gluCDCA) 激活孕甾烷X受体(PXR) 和芳基炔受体(AHR)上调胆固醇-3a-羟基酶1a (cyp3a1), 胆固醇-1a-羟基酶 (cyp1a1),和胆盐水解酶的表达。3-Ketolithocholica acid (3-ketoLCA) 和 isolithocholic acid (isoLCA) 抑制类视黄醇相关孤儿受体-γt(RORγt),抑制T helper 17 (TH17) 细胞的分化。IsoalloLCA连接核受体4A1(NR4A1),上调叉头盒蛋白3 (Foxp3)的表达,进一步促进T 调节 (Treg)细胞的分化。3-酮-LCA激活维生素D受体,调节RORγt+ Treg的功能。猪胆酸(HCA)和猪去氧胆酸(HDCA)抑制FXR信号,促进胰高血糖素样肽-1(GLP-1)的产生和分泌。HDCA抑制FXR,下调Fgf15表达,增加CYP7B1的表达,同时下调肝脏胆固醇转运体Abcg5/g8基因的表达。HDCA扰乱ras-相关核蛋白/m染色体区域维持过氧化物酶体增殖物激活受体α(RAN/CRM1/PPARα),加强PPARα的核分布,从而推动脂肪酸氧化和抑制炎性。HCA激活肾肝受体(LXR),下调甾醇调节元件结合蛋白2(SREBP2)、转化生长因子β(TGF-β)和核因子κB (NF-κB)。HCA和HDCA在肠道激活G偶联蛋白BA受体(TGR5),推动GLP-1的产生和分泌。并且HDCA在脑中激活TGR5,下调蛋白激酶B(AKT)和NF-κB信号通路。HDCA直接与toll受体4/髓系分化因子2(TLR4/MD2)复合体相互作用,竞争性抑制脂多糖(LPS)连接到TLR4/MD2。浅红色边表示受体被激活,深绿色则表示受体被抑制。
肠道微生物驱动的7a-脱羟基和生物免疫作用
7a-脱羟基一直被认为是一种基本的肠道微生物生物转化作用,然而,直到2020年胆汁酸的7a-脱羟基,即Hylemon-Björkhem途径才被明确。这条途径涉及到A/B环的立体异构,还有3-氧化和3-表异构化,导致alloBAs、isoalloBAs、3-酮-BAs和isoBAs异构体的产生。胆汁酸结构多样化是由一系列酶反应所驱动的。
DCA和LCA的异构体isoDCA和isoLCA也可以由两步过程产生,涉及到DCA和LCA的C-3位羟基异构化。首先由3α-羟固醇脱氢酶 (3α-HSDH)氧化C-3羟基,接着被3b-HSDH酶还原产生isoDCA和isoLCA。放线菌门和厚壁门的各种肠道微生物具有3α-HSDH酶,Gordonibacter pamelaeae, Eggerthella lenta, Clostridium citroniae和Ruminococcuse gnavus均有3β-HSDH酶。同样,DCA被12α-HSDH转化为12-酮-LCA,紧接着12β-HSDH酶催化12-酮-LCA为epiDCA 。
最近的研究指出,isoalloLCA和3-酮-LCA能促进T调节细胞(Treg)的分化,同时阻止T辅助细胞(TH17)的分化。IBD病人的isoalloLCA、isoLCA水平,及它们生物合成基因普遍低于对照组。
另外,isoDCA可以减少树突状细胞的炎性,推动Treg细胞的产生,以维持肠道免疫的平衡。isoDCA和isoLCA可以通过促进Treg细胞的分化,阻止TH17的发展,辅助IBD的治疗。在日本百岁老人中发现Iso-、3-酮-、allo-、3-酮-allo-和 isoalloLCA的含量富集,isoalloLCA能对抗革兰氏阳性多药耐药病原体,这与病原体感染的风险有关。
HCA类胆汁酸在代谢性疾病中的作用
人们对HCA类的胆汁酸的生物活性和机制越来越感兴趣,这类胆汁酸包括HCA、HDCA及其各自与甘氨酸和牛磺酸的结合物。这类在人体中稀有的胆汁酸的生物合成和机制至今还不十分清楚。
我们研究团队的前期工作揭示了HCA类胆汁酸是糖尿病预测的生物标志物和一种非常有前途的多靶点治疗药物。HCA类胆汁酸通过激活G偶联蛋白BA的受体(TGR5),并抑制FXR信号通路,促进胰高血糖素样肽-1(GLP-1)的生成和分泌,有效调节血糖平衡。此外,我们的研究还发现在代谢异常相关的肝病(MAFLD)血清中HCA水平降低,特别是HDCA和甘氨结合HDCA的降低。并且,HDCA能通过抑制肠道FXR促进肝脏替代途径BA的合成,同时通过调节肠道细菌激活过氧化物酶体增殖物激活受体a(PPARα)的信号通路抑制经典途径的BA合成。另外,HDCA在肝细胞内与ras相关的核蛋白结合,升高PPARα水平,增加脂肪酸的氧化,从而减少炎性,改善MAFLD。
此外,HDCA还具有其它一些有益的作用,包括抑制胆固醇结石、减缓炎症防止脓毒症、预防中枢神经炎症。HCA能降低肾结石的生成和积累、减轻高能量饮食导致的神纤维化、改善脂质代谢紊乱和免疫反应。
发现新型胆汁酸的代谢组学技术
新型胆汁酸的发现依赖于先进的代谢组学技术。非靶向的代谢谱与公共数据库搜索相结合,如GNPS和BAFinder,研究者们能识别出具有独特母核环的BA衍生物。靶向代谢组学定量已知的BAs,但它在鉴别新的BA成分方面的有效性可能会受到依赖现有知识和参考标准可用性的限制。
反向代谢组学是一种发现新型代谢物的新技术。当使用非靶向代谢组学筛选生物样本时,将所有代谢物特征与公共数据库和新合成的代谢物进行比较,可以揭示与特定表型、物种和样本类型相关的潜在代谢物。基于保留时间的注释策略和离子趟渡谱能有效的用于解释在BA酰化物中的异构体和差向异构体。且培养组学与代谢组学相结合被证明是一种在生物样本中发现新型胆汁酸的成功方法。质谱查询语言 (MassQL)、 小分子鉴定可信度(COSMIC)以及其它质谱分析方法是发现新型胆汁酸所必须的工具。
未来胆汁酸研究和新药发现的展望
过去五年里通过质谱技术、公共数据库搜索和生物信息计算工具相结合的方法,发现超过250个新的肠道微生物修饰的胆汁酸。随着人工智能技术(AI)在生物医学领域中的推广运用,我们预计AI可以促进大量以前未知的胆汁酸类型的筛选,并探索胆汁酸修饰的特定微生物群。AI还可以预测参与胆汁酸代谢的酶的功能,揭示胆汁酸新的修饰途径,甚至重塑已知的微生物代谢途径。并且,因为细菌和真菌均可以修饰胆汁酸,探索真菌对胆汁酸的修饰很可能会是该领域未来广阔的研究前景,我们可以更全面地了解肠道微生物群和宿主健康之间的复杂相互作用。
胆汁酸作为一种内源性配体,为开发具有增强活性的半合成衍生物奠定了坚实的基础,使其成为候选药物筛选的先导化合物。例如,INT-787目前正在进行治疗严重性酒精性肝炎的II期临床试验;EDP-305是奥贝胆酸的侧链衍生物,是一种很有希望的FXR激动剂,目前正在评估其治疗MASH的潜力;Aramchol是一种由Galmed制药公司开发的硬脂酰辅酶A去饱和酶1抑制剂,正处于用于MASH和肝纤维化的III期临床试验阶段;HTD1801(即小檗碱熊去氧胆酸盐)正在进行多种适应症的临床试验,包括MASH、T2D、严重高甘油三酯血症、原发性硬化性胆管炎和原发性胆道胆管炎。
从这些临床试验中,我们可以推断微生物对BA母核的修饰,可以增强或改变BA衍生物与宿主体内受体的亲和力,从而产生新的生物活性。重要的是这为未来发现新的候选药物提供了先导化合物,接下来的研究有望揭示这些改变在不同健康条件下的额外变化,从而增强我们对它们在身体功能中的多方面作用的理解。
结论
胆汁酸的研究揭示了宿主和微生物群之间复杂的相互作用,同时也揭示了这种相互作用如何深远地影响宿主代谢。利用先进的分析技术和代谢组学技术,研究人员可以加速对以前未发现的胆汁酸微生物修饰的探索,并有效筛选出潜在的新候选药物。
衷心感谢本文作者及团队授权并为麦特绘谱公众号文献解读供稿,您的专业成果与深刻见解为广大研究者带来了宝贵的知识财富,开启了胆汁酸研究的全新视野。
原文信息
Zheng D, Zhang H, Zheng X, Zhao A, Jia W. Novel microbial modifications of bile acids and their functional implications. iMeta. 2024.
请扫描二维码阅读原文