产品简介
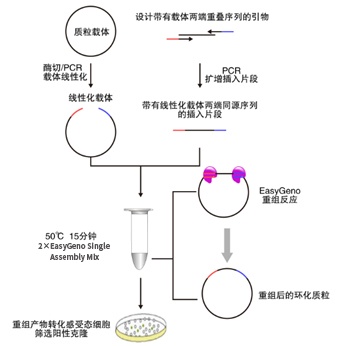
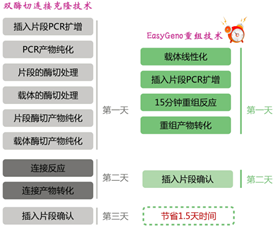
EasyGeno单片段重组克隆试剂盒基于DNA序列同源性进行片段重组,可快速将单个片段定向克隆到任意线性化载体中。通过精心设计和严格试验,本试剂盒含有的2×EasyGeno Single Assembly Mix具有的酶活性可将载体和片段的同源区域从双链的3’端进行重组连接,终得到的无缺口闭环质粒可直接转化感受态细胞筛选克隆。该方案克服了酶切位点的限制,仅需在插入片段PCR引物5’端引入线性化载体的末端序列,使得插入片段5’和3’两端带有载体两端的致性序列(15-25 bp),即可实现插入片段的定向重组进入载体。重组反应可在恒温条件下快速进行(50 ℃处理15 min),配合灵活的PCR产物处理方式和快速转化方法,数小时内即可完成从DNA样品准备到重组产物的转化涂板培养的全部操作。
产品特点
1. 无需考虑酶切位点限制,通过序列同源性15 min实现载体与片段的快速重组。
2. 插入片段的PCR产物正确且单,无需纯化,可直接与载体进行重组反应。
产品简介
EasyGeno单片段重组克隆试剂盒基于DNA序列同源性进行片段重组,可快速将单个片
段定向克隆到任意线性化载体中。通过精心设计和严格试验,本试剂盒含有的2×EasyGeno
Single Assembly Mix具有的酶活性可将载体和片段的同源区域从双链的3'端进行重组连接,
终得到的无缺口闭环质粒可直接转化感受态细胞筛选克隆。该方案克服了酶切位点的限
制,仅需在插入片段PCR引物5'端引入线性化载体的末端序列,使得插入片段5'和3'两端带
有载体两端的致性序列(15-25 bp),即可实现插入片段的定向重组进入载体。重组反应
可在恒温条件下快速进行(50℃处理15 min),配合灵活的PCR产物处理方式和快速转化方
法,数小时内即可完成从DNA样品准备到重组产物的转化涂板培养的全部操作。
产品特点
1. 无需考虑酶切位点限制,通过序列同源性15 min实现载体与片段的快速重组。
2. 插入片段的PCR产物正确且单,无需纯化,可直接与载体进行重组反应。
3. 可以选择性进行5 min快速转化E.coli感受态细胞。
4) 向转化体系中加入200 μl 无菌的SOC或LB培养基(不含抗生素)混匀。混匀后,吸取
200 μl已转化的感受态细胞直接加到含相应抗生素的SOB或LB固体琼脂培养基上,用无
菌的平板涂布玻璃珠(GB101)或涂布棒轻轻的将细胞均匀涂开。将平板置于室温直至
液体被吸收,倒置平板,37℃培养6-9 h。
注意:对于氨苄青霉素抗性的载体,混匀后直接涂板。对于硫酸卡那霉素抗性或其他抗
性的载体,37℃摇床中180 rpm振荡培养45-60 min后,吸取100-200 μl进行涂板。
检测
1. 常规检测:将得到的菌落接种1-5 ml LB(含有相应浓度抗生素)培养基,37℃摇床振荡
培养过夜,保存菌种后提取质粒,应用PCR或酶切方法鉴定插入片段是否正确。
Control Insert DNA的PCR鉴定,请参考以下反应条件:
95℃ 2 min
94℃ 30 sec
55-65℃ 30 sec 30 cycles
72℃ 1 kb/min
72℃ 5 min
4℃ ∞
注意:检测引物的退火温度基于引物自身序列而定,并建议使用载体引物进行检测,
PCR延伸时间建议1 kb/min。
2. 快速检测:挑取菌落直接进行PCR检测(具体方法见分子克隆第三版)。
3. 测序鉴定:使用常规或快速方法进行初步的鉴定后进行序列的测定。
向感受态细胞悬液中加入5-10 µl重组产物(100 µl的感受态细胞能够被1 ng超螺旋质粒
DNA所饱和),轻弹混匀,在冰浴中静置30 min。
注意:所用DNA体积不要超过感受态细胞悬液体积的十分之。以下实验以50 μl感受态
细胞为例。
3) 将离心管置于42℃水浴中放置60-90 sec,然后快速将管转移到冰浴中,使细胞冷却2-3
min,该过程不要摇动离心管。
4) 向每个离心管中加入350 µl无菌的SOC或LB培养基(不含抗生素), 混匀后置于37℃摇床
振荡培养45 min(180 rpm),目的是使质粒上相关的抗性标记基因表达,使菌体复苏。
5) 将转化体系混匀,吸取100 μl已转化的感受态细胞加到含相应抗生素的SOB或LB固体琼
脂培养基上,用无菌的平板涂布玻璃珠(GB101)或涂布棒轻轻的将细胞均匀涂开。将
平板置于室温直至液体被吸收,倒置平板,37℃培养12-16 h。
注意:如若基于以往经验克隆数较少,可将菌液4000 rpm离心10 min收集菌体,弃去培
养基,加入100-200 μl的SOC或LB培养基重悬菌体,并转移至含相应抗生素的SOB或LB
固体琼脂培养基上均匀涂开。
感受态菌落的生长速度取决于菌株的种类、所转化质粒的种类及所携带的抗性基因。
(2) 快速转化流程
1) 取T-Fast感受态细胞置于冰浴中,如需分装可将刚融化细胞悬液分装到无菌预冷的离心管
中,置于冰浴中。
注意: 次转化感受态细胞的建议用量为50-100 μl,可以根据实际情况分装使用。
2) 待感受态完全融化以后,向感受态细胞悬液中加入5-10 µl重组产物(100 µl的感受态细胞
能够被1 ng超螺旋质粒DNA所饱和),轻轻混匀,不要涡旋,并在冰浴中静置2 min。
注意:所用DNA体积不要超过感受态细胞悬液体积的十分之。以下实验以100 μl感受
态细胞为例。
3) 将转化体系于42℃水浴中放置90 sec,然后快速将管转移到冰浴中,使细胞冷却2 min,
该过程不要摇动离心管。
注意事项 请务必在使用本试剂盒之阅读此注意事项
1. 对于单个片段的PCR产物进行重组时,如果PCR条带单,可以直接进行重组反应,加
入体积不要超过重组体系的20%,重组效率要低于使用纯化后的PCR产物进行重组。
2. 如果想保留酶切位点进行后续的鉴定,建议增加缺失的酶切位点序列。
操作步骤
1. 线性化载体的制备
质粒的线性化不彻底将导致阴性克隆的产生,所以般建议通过双酶切或PCR扩增的方
法进行质粒的线性化,然后通过胶回收的方法回收纯化载体。对于以质粒模板进行扩增的
PCR产物,建议使用DpnⅠ内切酶消化残存的质粒模板。
2. PCR产物的准备
PCR产物的扩增建议使用高保真性聚合酶,如Pfu DNA polymerase (EP101),Ultra
HiFidelity PCR Kit (KP203)等。
(1)进行插入片段克隆的引物设计原则
线性化载体的末端可以是酶切得到的平末端(图2a)、3’突出末端或5’突出末端(图
2b),或者是PCR得到的平端类型(图2a)。在引物设计时,遵循的原则是同源区域序
列的选择与载体的3’末端序列对齐为准,例如,酶切位点产生得到5’突出末端,以另外
条链3’ 端得到的序列开始计算出15 nt的长度作为同源序列。正向引物为与载体左臂重叠
区域(15-25 nt)加上基因插入片段正向序列(22 nt左右),反向引物为与载体右臂重叠
区域(15-25 nt)加上基因插入片段反向序列(22 nt左右)。
人原代附睾管上皮细胞
(2021-07-08T14:16 浏览数:20725)
雅吉生物热烈庆祝中国建党100周年
(2021-07-02T09:17 浏览数:15457)
15P-1 (小鼠睾丸上皮细胞) (STR鉴定正确)
(2021-06-23T09:59 浏览数:18504)
客户细胞培养过程中常见的问题说明
(2021-06-18T09:54 浏览数:21114)
免疫荧光鉴定步骤
(2021-06-18T09:54 浏览数:22616)
人真皮成纤维细胞的分离培养制备方式
(2021-06-17T09:04 浏览数:18689)
原代角质形成细胞的分离培养方法
(2021-06-17T09:03 浏览数:22154)
钻石探头量子显微镜可以探索纳米微观世界的奥秘
(2021-06-16T09:24 浏览数:20463)
过氧化物酶体活化受体可以加剧肿瘤形成
(2021-06-16T09:23 浏览数:18549)
式细胞术数据分析之——圈门技巧
(2021-06-15T10:11 浏览数:18980)


