类器官构建完成后总要进行一系列的染色:
首先,染色可以帮助研究人员更清晰地观察和研究类器官的结构和形态。通过染色,类器官的细胞和组织可以被赋予不同的颜色或荧光特性,从而使其在显微镜下更易于观察和识别。这有助于研究人员更准确地分析类器官的细胞组成、排列方式以及细胞间的相互作用。
其次,染色可以揭示类器官的特定生物学特性。不同的染色方法可以用于检测类器官中的特定分子、蛋白质或基因表达,从而深入了解类器官的功能和机制。这些信息对于理解类器官的发育、生理和病理过程至关重要。
此外,染色还有助于研究人员进行定量分析。通过对染色后的类器官进行图像分析和数据处理,可以定量评估类器官的大小、细胞数量、细胞增殖率等参数。这对于评估类器官的生长状态、药物反应以及疾病模型的建立具有重要意义。
最后,染色还可以用于类器官的鉴定和分类。通过特定的染色方法,可以将不同类型的类器官区分开来,从而便于研究人员进行针对性的研究。
那么我们就来看看类器官怎么染色:
好看的类器官都是染出来的,你可能不信,确实,除了染色,一台4通道的共聚焦显微镜也很重要。
染色需要的材料:
正常血清(使用与产生第二抗体相同的物种)
牛血清白蛋白
Triton™X-100
吐温®20
D-PBS
200µL宽口径移液管尖端(Corning®,T-205-WB-C-R-S)
4%溶解了多聚甲醛的PBS溶液
DAPI
柠檬酸盐缓冲液
从Matrigel中回收类器官
注:此优化适用于直径在50至500µm之间的类器官。建议每个面板至少使用100个类器官,。如果类器官的直径小于50µm,请继续培养。如果类器官的直径为1毫米或更大,则该方案不适用。
注:类器官悬浮液(即在不存在Matrigel®或具有非胶凝Matrigel™浓度的情况下生长)不需要回收。
用防粘连清洗液(我采用的是0.9%的氯化钠溶液)预冲洗15 mL锥形管。上下颠倒轻轻摇晃,以确保管壁涂有冲洗溶液。
注:预冲洗可防止类有机物粘附在培养物上,并显著提高类有机物的回收率。
操作步骤:
1. 从孔板吸出培养基弃掉,PBS清洗两次,并向孔中加入1mL预热的细胞解离试剂
注:我采用的是启达组织消化酶(SD0013)
2. 切下1 mL移液管尖端(或使用宽口径移液管末端),并用防粘连冲洗液进行预冲洗。使用相同的尖端(轻轻地)研磨孔板两次,然后将类器官转移到步骤1中制备的管中。
注:将孔板底分解成更小的碎片可以更有效地消化Matrigel®。从Matrigel®中释放类器官对于防止Matrigel™干扰下游染色非常重要。避免过度或苛刻的研磨,这可能会剪切或损坏类器官。
3.将管子侧面放在冰上。将冰盒放在旋转或倾斜平台上,搅拌Matrigel®-类有机悬浮液20分钟。
4.用防粘连冲洗溶液切割并预冲洗1 mL移液管尖端(或使用宽孔移液管末端),然后使用相同的尖端(轻轻地)研磨Matrigel®碎片。
5.将试管放回冰上,在搅拌下再孵育20分钟。
注:当Matrigel®溶解并且类器官开始在悬浮液中漂浮时,培养完成;这可能需要长于1小时的孵育。
6.600-800转离心让类器官在重力作用下沉淀。
7.吸取上清液,上清液中应含有大部分Matrigel®。继续进行类器官固定步骤。
注:如果需要做多重染色,每个抗体板只染色一个孔板。例如,如果你打算用4个不同的抗体染色,可以从4个孔板收集类器官。注意,根据每个孔板的类器官数量,可能需要进行一些优化。当一个类器官要染多种颜色的时候,需要确保抗体组合来自不同物种,以避免染色过程中的交叉反应。
固定
化学固定有两种主要方法:脱水和交联。脱水固定剂(如甲醇)去除并取代蛋白质周围的游离水,导致蛋白质变性和原位沉淀。交联固定剂(如多聚甲醛)与蛋白质发生化学反应,形成分子间和分子内共价桥。脱水通常会导致更高的免疫反应性,但形态较差,蛋白质损失高。交联导致极好的形态结构,但也可导致表位掩蔽和抗体排斥。应通过实验确定每个组织和每个抗体-抗原相互作用的最佳固定方法。一般来说,PFA固定后再进行抗原回收可获得最佳结果。
1. 用防粘连冲洗液预冲洗1.7 mL微量离心管。
2. 从类器官沉淀中取出上清液,并将类有机物重悬于1 mL 4%PFA中。
3. 在防粘连冲洗溶液中预先冲洗1 mL移液管尖端,并使用相同的尖端将类有机物从15 mL锥形管轻轻转移到步骤1中制备的微量离心管中。
4. 将试管放在一边,在PFA中轻轻摇晃45分钟。
注:尽管不同组织的最佳固定时间因其大小和密度(以及固定剂的类型)而异,但45-60分钟的固定时间将确保大多数形状和大小的类器官(即直径达500µm的类器官)的完全固定。
孵育期后,在IF缓冲液中洗涤类有机物一次,以消除残留的PFA。洗涤后让类器官沉淀。
注意:一般情况下,进行一次清洗就足够了。如果需要,可以进行第二次洗涤,洗涤后需要离心收集类器官
5. 将类器官重新悬浮在1mL PBS中,并进行抗原回收步骤。
注:类器官可在2-8°C的PBS中长期储存;但会导致抗原丢失,所以请立即进行下一步
抗原回收
一些固定剂导致表位交联,从而掩盖表位并减少抗原-抗体结合。虽然抗原回收通常被推荐用于基于福尔马林的固定剂,但其需求将取决于几个因素,如靶抗原、使用的抗体、组织类型以及固定的方法和持续时间。当对某些抗原(例如角蛋白8/18)进行染色时,抗原回收是必不可少的,但对其他抗原(例如乙酰化微管蛋白)是可选的。固定在甲醇或其他有机溶剂中的样品不应进行抗原回收。
注:抗原回收仅适用于固定在PFA或其他交联剂中的样品。用酒精或其他脱水型固定剂固定的样品不应煮沸。
1.吸取PBS并向类器官中加入1mL柠檬酸缓冲液。
2.将1.7 mL试管加热块设置为98°C。一旦加热块达到96-98°C,将试管放在加热块中并孵育20分钟。
3.关闭加热块。让类有机物在加热块中再放置20分钟,同时冷却。
注意:注意:此时管子可能会很热。如果需要,用镊子取下管子
4.继续渗透和封堵步骤。
细胞渗透和阻断
注:细胞的渗透作用仅用于细胞内靶标。如果评估表面标记,则无需进行渗透处理。甲醇固定样品可能不需要渗透。
1. 通过向渗透性溶液中加入5%血清形成渗透性/封闭性溶液。
注:用于阻断的动物血清应与第二抗体的宿主相同。例如,如果你计划使用驴二次抗体,这一步应该使用驴血清。每次添加新鲜血清(即不要将渗透/封闭溶液与血清长期储存)。
2. 吸取柠檬酸盐缓冲液,向类有机物中加入1 mL渗透/封闭溶液。将试管侧放在滴定平台上,在室温下搅拌培养1-72小时。
注:潜伏期可能需要针对每种组织、抗原和抗体进行优化。然而,潜伏期通常在1-72小时之间,背景信号几乎没有差异。
注:如果细胞已固定在PFA中,则考虑在阻断前用0.3M甘氨酸洗涤类器官30分钟。甘氨酸将与未反应的醛基结合,以猝灭PFA自发荧光,并防止游离醛与一级或二级抗体反应,从而引起高背景信号。
预染
1. 吸入渗透/封闭溶液,在IF缓冲液中洗涤3次。在每次洗涤之间让类器官静置5分钟。
2. 加入0.5 mL-1 mL一级抗体混合物。在IF缓冲液中制备初级抗体。
注:强烈建议在这一点上留出一些类器官,用作同种型对照和/或仅用于二级对照——特别是如果抗原罕见或抗体是新的。
3. 将试管侧放在倾斜平台上,在室温下轻轻搅拌培养16-72小时。
注:类器官全悬置的典型一抗稀释液为1:400-1:800;根据抗体的需要进行滴定。抗体不同,稀释的倍数也会不同,需要自己去优化稀释倍数。使用尽可能少的抗体来减轻背景信号。
复染
注:第二抗体的典型抗体稀释度在1:500和1:1000之间。根据抗体的不同进行优化稀释倍数.
1. 吸取初级抗体溶液,在IF缓冲液中洗涤3次。在每次洗涤时让类器官静置5分钟。
2. 加入0.5 mL-1 mL的第二抗体混合物。在补充有10%驴血清的IF缓冲液中制备第二抗体。
注:第二抗体必须针对与第一抗体相同的同种类型进行培养。例如,如果使用小鼠IgM作为主要免疫球蛋白,则需要使用抗小鼠IgM来作为次要免疫球蛋白。
3. 将试管侧放在倾斜平台上,在室温下轻轻搅拌培养16-72小时。在培养过程中,避免将类器官暴露在光线下。
注:在一级或二级抗体孵育后期间,类器官都可以在2-8°C的IF缓冲液(不含抗体)中储存3天以下(在黑暗中,不摇晃)。为了获得最佳效果,请尽快执行下一步操作。
注意:为了最大限度地减少背景荧光或虚假信号,重要的是,您的共轭二级抗体的发射光谱不要彼此广泛重叠。请参阅制造商的规范,以确定所需荧光剂的激发光谱和发射光谱。
包埋
1. 将DAPI直接加入类器官中,最终浓度为2-4µg/mL。将试管放在一边,在室温下在黑暗中轻轻搅拌培养15-20分钟。
注:如果需要,可以在添加DAPI之前对样品进行清洗
注:如果用DAPI进行复染,最好使用红色或远红色的次级抗原来检测核抗原,以确保任何DAPI溢出到下游通道都不会提供假阳性。
2. 抽吸DAPI/类器官溶液,在水中和PBS中洗涤一次类器官。每次洗涤之间让类器官静置5分钟。
注:在这个阶段,类器官可以转移到玻璃底室载玻片上(例如来自Ibidi的8孔室载玻片),并在PBS中成像,而不需要清除。但是清除以获得最佳结果。
清理和固化
注:强烈建议进行光学清理。该工艺不仅通过减少光散射来提高整体信噪比,还可以保护荧光团和染料免受猝灭(褪色)。免疫标记和清除的类器官可以在室温下储存在ProLong™Gold Antifade Mountant中长达6个月,信号强度损失最小。
1. 吸取上清液,将类器官沉淀重悬于1 mL 50%甲醇PBS中。将试管侧放在倾斜平台上,在室温下在黑暗中轻轻搅拌至少1小时。
2. 取出50%甲醇溶液,向类器官中加入1mL 100%甲醇。将试管侧放在倾斜平台上,在室温下在黑暗中轻轻搅拌至少1小时。
3. 使用200µL移液管末端,尽可能多地吸出甲醇溶液。
4. 在50µL金防垢剂中重新悬浮类有机颗粒。
5. 将类器官悬液均匀滴到玻璃显微镜载玻片的中心。
注意:安装件很粘稠。缓慢抽吸和滴入以避免气泡。对于较大的类器官,需要在抽吸前剪掉200µL移液管尖端。
将盖玻片放在类器官上,轻轻盖住。
注:从一面向另一面轻轻盖住,不要产生气泡,使用指甲油密封
在成像之前,让贴片固化至少24小时。
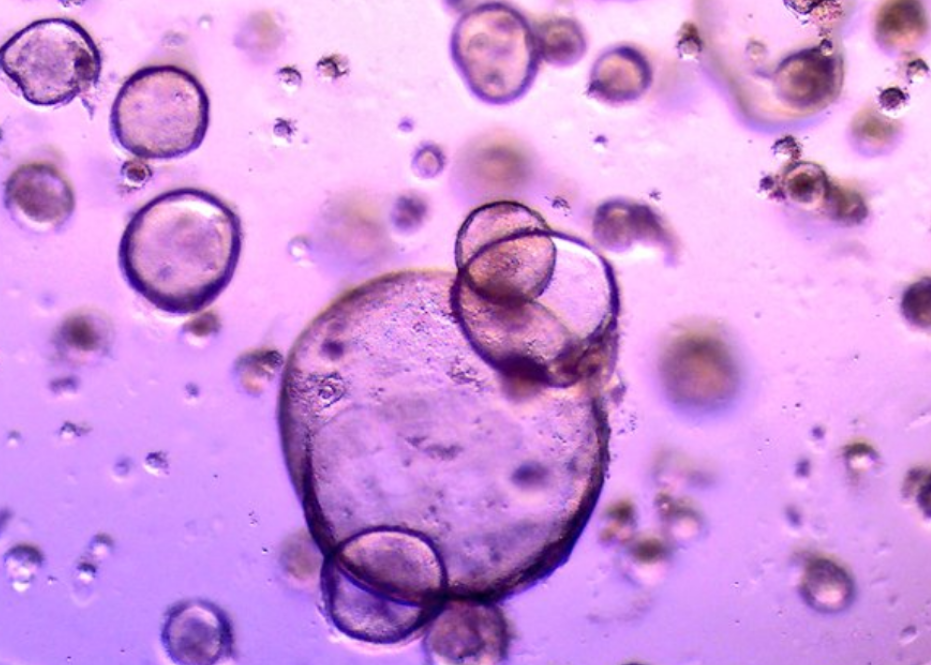
肾类器官未染色前
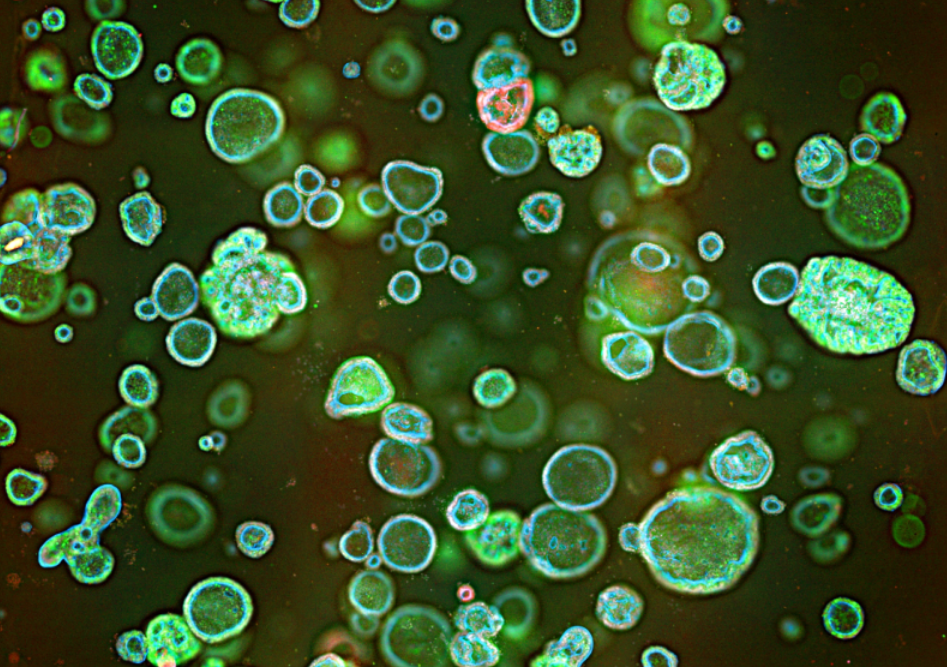
染色后
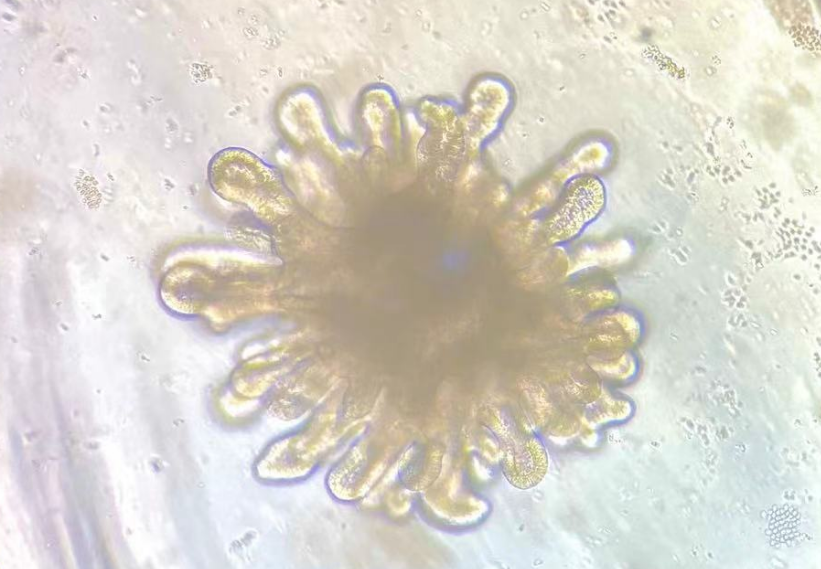
小鼠肠类器官
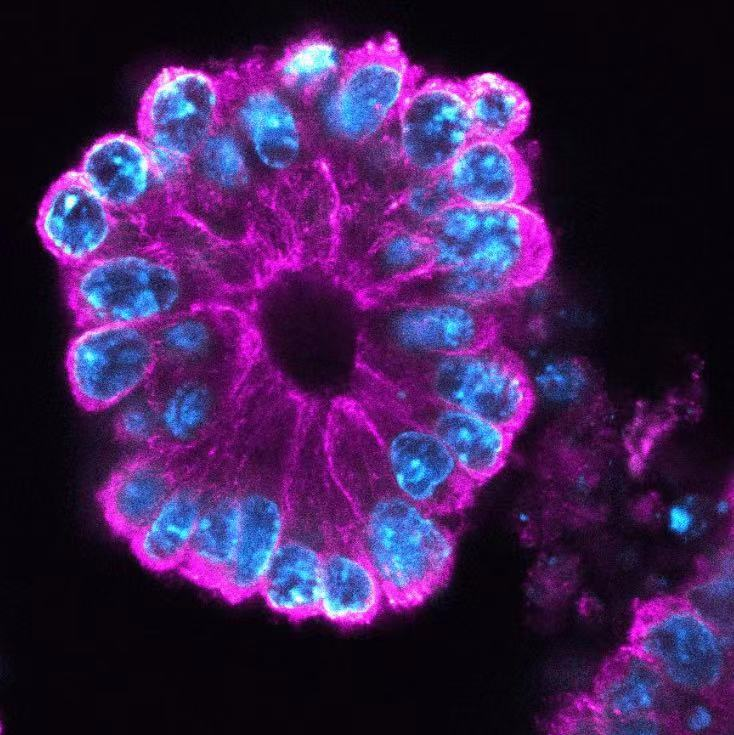
小鼠小肠类器官染色
