01 研究背景
2019冠状病毒病(COVID-19)的发病机制受活性氧(ROS)的影响,然而其具体机制尚不明确。冠状病毒SARS-CoV-2核衣壳蛋白(S2NP)是该疾病的主要驱动因子,也是病毒复制和组装不可或缺的结构蛋白,但其在ROS生成中的作用尚未报道。2023年11月,华中科技大学同济医学院基础医学院刘超红教授团队在Journal of Medical Virology (IF 12.7) 上发表文章“SARS-CoV-2 nucleocapsid protein enhances the level of mitochondrial reactive oxygen species”,发现S2NP表现出显著的线粒体定位,与线粒体转录成分相互作用并稳定其蛋白水平;此外S2NP还会损害抗氧化酶的活性,表明S2NP可能通过多种机制促进线粒体ROS的产生。
· 维真助力 - 腺病毒 ·
基因信息
S2NP:SARS-CoV-2核衣壳蛋白
病毒产品
Ad5-S2NP,Ad5-NC
感染细胞
人肺癌细胞A549(MOI:100),
人支气管上皮细胞 HBE
02结果展示
1. S2NP可提高线粒体ROS水平
为了探究S2NP是否影响线粒体ROS水平,作者利用腺病毒5型载体在A549细胞中过表达S2NP,并使用MitoSOXTM(活性氧荧光探针)检测细胞内活性氧水平。流式细胞分析显示,S2NP过表达组比对照组表现出更高水平的线粒体ROS。为了进一步研究S2NP增强线粒体ROS水平的潜在机制,作者进行了RNA测序,发现S2NP过表达组表现出明显的转录组改变,所有线粒体编码蛋白的mRNA水平均上调,qPCR进一步验证了这一结果。GO分析发现 “氧化磷酸化”、“ATP合成耦合电子传递”、“呼吸电子传递链”等过程相关基因显著富集。
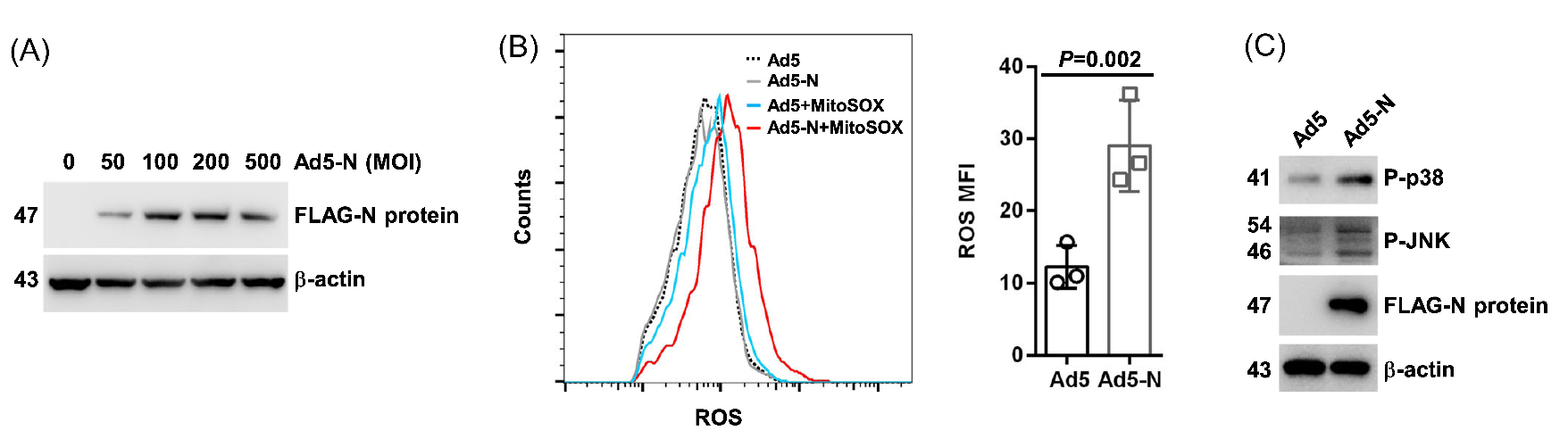
图1. S2NP可提高线粒体ROS水平
2. S2NP的表达增强了复合物I和III的活性
RNA测序表明S2NP会损害ATP合成和电子传递,作者检测了S2NP对ATP生成的影响,发现S2NP过表达组细胞内ATP水平低于对照组,表明S2NP的表达阻碍了ATP的产生。ATP合成过程中的电子泄漏主要发生在复合物I和III上,作者发现S2NP的表达导致复合物I活性弱增强,复合物III活性显著增强,转录组结果也显示线粒体编码的复合体I和III蛋白的mRNA水平在S2NP过表达细胞中上调,IB实验也证实MT-ND1、MT-ND2、MT-ND3、MT-ND4、MT-ND6和MT-CYB的蛋白水平在S2NP过表达细胞中增加。这些数据集表明S2NP蛋白部分增强了复合物I和III的活性。亚细胞定位实验表明,S2NP显示出明显的线粒体定位。
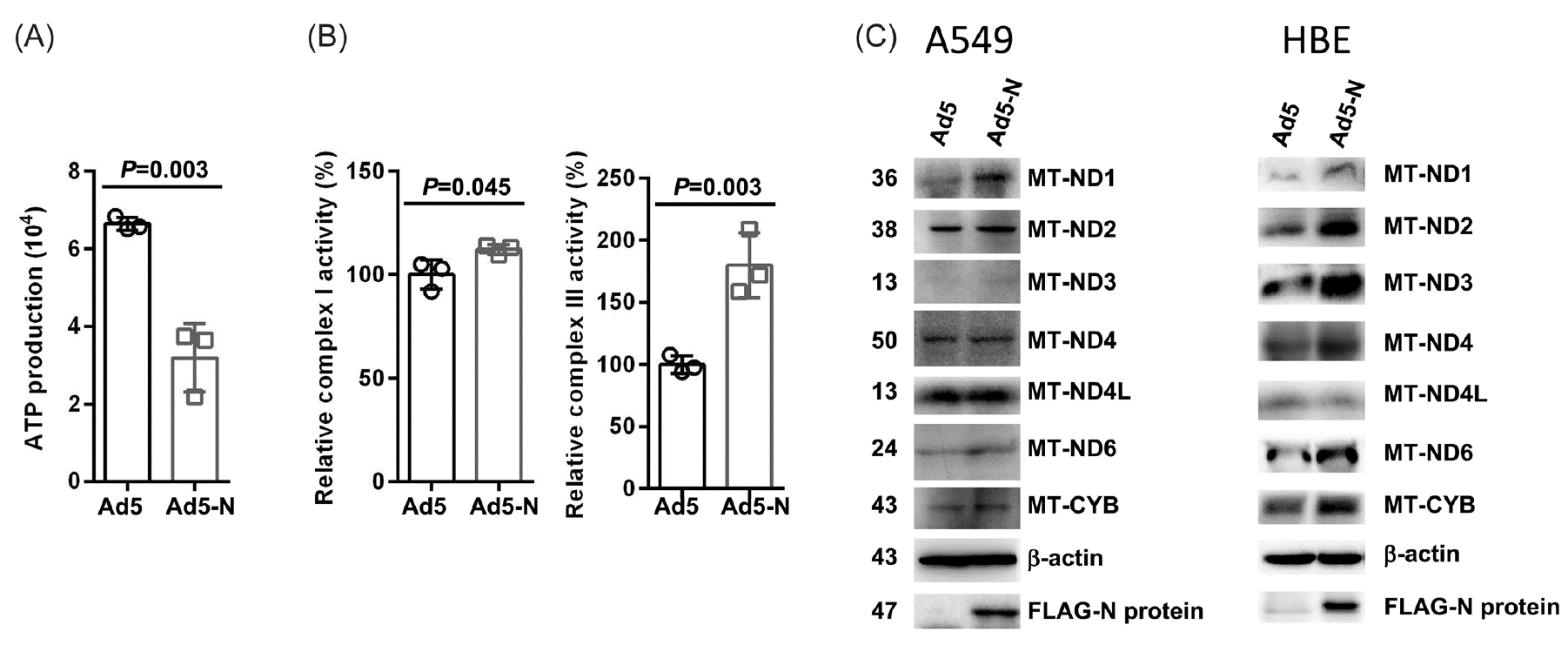
图2. S2NP的表达增强了复合物I和III的活性
3. S2NP通过泛素-蛋白酶体系统增强线粒体转录组分的稳定性
线粒体编码的13种蛋白质是ATP合成和电子传递所必需的,其转录是在线粒体转录因子A (TFAM)和线粒体转录因子B2 (TFB2M)的参与下进行。RNA测序发现POLRMT、TFB2M和TFAM的mRNA与S2NP无关,但POLRMT、TFB2M和TFAM蛋白水平在S2NP过表达细胞中明显升高。MG132(蛋白酶体抑制剂)能导致A549细胞中POLRMT、TFB2M和TFAM蛋白水平升高,表明这些蛋白在动态平衡中经历蛋白酶体依赖性降解。在MG132存在的情况下,S2NP过表达对POLRMT、TFB2M和TFAM蛋白水平的增强作用减弱,表明S2NP阻断了蛋白酶体依赖性线粒体转录成分的降解。作者还发现S2NP表达会阻断A549细胞中TFAM的泛素化。这些数据表明S2NP通过结合并稳定线粒体转录成分来促进线粒体编码的复合物I和III蛋白的转录。
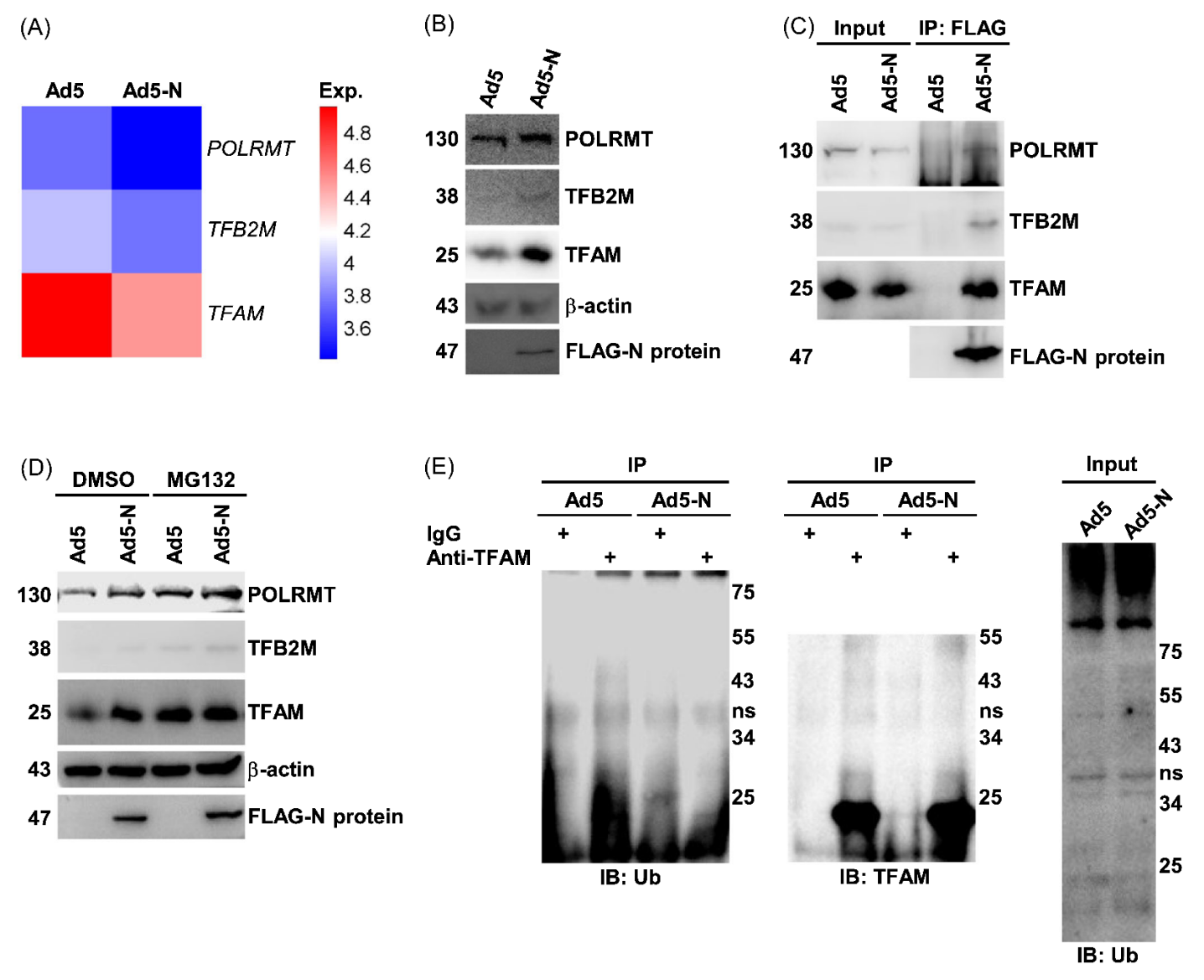
图3. S2NP通过泛素-蛋白酶体系统增强线粒体转录组分的稳定性
4. S2NP损害抗氧化酶的活性
有研究表明ROS水平的增加导致抗氧化酶的表达降低,RNA测序结果显示, S2NP的表达导致SOD1、GPX1、GPX3和GPX4水平降低,GPX2水平升高。qPCR实验无法证实SOD1的下调,但它证实了S2NP表达后CAT和GPX8水平不变,GPX2水平升高,GPX4水平降低,IB实验表明S2NP过表达细胞中SOD1蛋白表达降低,CAT和GPX8蛋白水平不变。因此,SOD1数据的差异可能是PCR引物特异性较低所致。测定抗氧化酶的活性显示,S2NP部分抑制SOD和GPX的活性,这与转录组结果一致。综上所述,这些数据表明会损害抗氧化酶的活性。
图4. S2NP损害抗氧化酶的活性
03实验结论
本研究发现S2NP表达可提高线粒体ROS水平,增强线粒体转录组分的稳定性;S2NP增强了电子传递复合物I和III的活性,损害抗氧化酶的活性。在机制上,S2NP表现出显著的线粒体定位,与线粒体转录成分相互作用并使其保持稳定,从而提高线粒体ROS水平。
